नमस्कार आज हम विज्ञान के महत्वपूर्ण अध्याय में से एक धातु (Metal) के बारे में पढ़ेंगे। इस अध्याय के अध्ययन के दौरान हम विभिन्न बिन्दुओं पर गौर करेंगे जैसे धातु किसे कहते हैं? धातु के उदाहरण, धातु के प्रकार, धातु के गुण, धातु के उपयोग, अधातु किसे कहते हैं? मिश्र धातु किसे कहते हैं? इत्यादि पर विस्तार पूर्वक चर्चा करेंगे। इस चर्चा के दौरान हम बहुत से महत्वपूर्ण प्रश्नों को हल भी करेंगे ताकि हम हमारा आंकलन कर सके। तो आइये शुरू करते है और जानते है की धातु किसे कहते हैं?
धातु किसे कहते हैं?
● तत्व जो इलेक्ट्रॉन त्यागकर धनायन बनाने की प्रवृत्ति रखते हैं, धातु कहलाते हैं।
● धातुएँ आर्वत सारणी में बायीं ओर एवं मध्य में स्थित हैं।
● ऐसे तत्व जो सबसे अधिक बायीं ओर स्थित है उनमें धातुओं के गुण अधिकतम पाए जाते हैं।
● प्राचीन काल में केवल आठ धातुएँ कार्बन, सोना, चाँदी, टीन, सीसा, लोहा, पारा तथा एन्टिमनी ही ज्ञात थी। ये धातुएँ प्रागैतिहासिक धातु कहलाती हैं।
● वर्तमान समय में 93 धातुएँ ज्ञात है।
धातु की परिभाषा
तत्व जो इलेक्ट्रॉन त्यागकर धनायन बनाने की प्रवृत्ति रखते हैं, धातु कहलाते हैं।
❒ धातुओं के भौतिक गुण –
● धातुएँ आघातवर्ध्य (Malleable) होती है अर्थात इन्हें पीटकर पतली चादर में परिवर्तित किया जा सकता है। सबसे अधिक आघातवर्ध्य धातुएँ सोना और चाँदी है।
● कमरे के ताप पर मर्करी के अतिरिक्त सभी धातुएँ ठोस अवस्था में पाई जाती है।
● पोटैशियम, सोडियम तथा कैल्सियम को छोड़कर सामान्यत: सभी धातुएँ कठोर होती है, लेकिन प्रत्येक धातु की कठोरता भिन्न-भिन्न होती है।
● धातुएँ तन्य (Ductile) होती है, लेकिन सभी धातुओं की तन्यता भी असमान होती है। सोना सबसे अधिक तन्य धातु है।
● 1 मिली ग्राम सोने से 200 मीटर लंबा तार खींचा जा सकता है। जबकि 100 मिली ग्राम चाँदी से लगभग 200 मीटर लंबा तार खींचा जाता है।
● धातुएँ ऊष्मा की सुचालक हैं। सिल्वर एवं कॉपर ऊष्मा के सबसे बेहतर चालक है, जबकि लैंड तथा मर्करी ऊष्मा के कुचालक हैं।
● धातुओं के गलनांक उच्च होते हैं, लेकिन अपवाद स्वरूप गैलियम एवं सीजियम धातुओं के गलनांक कम होते हैं।
● सामान्यत: धातुओं के घनत्व उच्च पाए जाते हैं, लेकिन सोडियम एवं पोटैशियम को छोड़कर।
● सभी धातुएँ विद्युत की सुचालक होती हैं, चाँदी को विद्युत का सर्वोत्तम चालक माना जाता है।
● धातुएँ चमकदार होती है क्योंकि ये अपने ऊपर से प्रकाश को परावर्तित कर देती हैं। जबकि अधातुएँ अपने ऊपर पड़ने वाले प्रकाश को अवशोषित कर लेती है।
● धातुओं में आबंध बनाने का गुण ही इन्हें अधातुओं से अलग करता है। आबंध के इसी गुण के कारण धातुएँ अपरूप होती है।
❒ धातुओं के रासायनिक गुण –
● जैसा कि हम जानते हैं धातुएँ प्रकृति में विद्युत धनात्मक होती है। अत: धातुएँ अधातुओं से आसानी से क्रिया कर लेती है।
धातुओं की ऑक्सीजन के साथ अभिक्रिया –
● अधिकांश धातुएँ ऑक्सीजन से अभिक्रिया करके ऑक्साइड बनाती हैं।
● यह अभिक्रिया धातुओं को गर्म करके एवं बिना गर्म किए अर्थात दोनों तरह से संभव है।
● गर्म किए बिना होने पर जैसे-सोडियम, कैल्सियम एवं पोटैशियम बनाती है।
● जबकि गर्म करने पर ऑक्सीजन से क्रिया करके ऑक्साइड बनाती है–
4Na+O2 → 2Na2O
2Mg+O2 → 2MgO
4Al+3O2 → 2Al2O3
● धातुओं के ऑक्साइड प्राय: क्षारकीय होते हैं, जो जल के साथ क्रिया करके क्षार देते हैं। जैसे- K2O, MgO, CaO, Na2O
CaO+ H2O → Ca (OH)2
Na2O+H2O → 2NaOH
● जिंक (ZnO), टिन (SnO), फैरिक (Fe2O3) तथा एल्यूमीनियम (Al2O3) के सभी ऑक्साइड अम्लों एवं क्षारकों से अभिक्रिया करते हैं अर्थात यह प्रकृति के उभयधर्मी हैं –
Al2O3 +6HCl → 2AlCl3+ 3H2O
Al2O3+ 2NaOH → 2Na AlO2 +H2O
धातुओं की अम्लों के साथ अभिक्रिया–
● धातुएँ साधारण अम्लों जैसे-तनु HCl एवं तनु H2SO4 में घुलकर हाइड्रोजन गैस उत्पन्न करती है।
● Mg रिबन व तनु HCl में अभिक्रिया निम्न प्रकार से संपन्न होती है–
Mg+2HCl → MgCl2+ H2
Zn+H2SO4 → ZnSO4+ H2
धातुओं की जल के साथ अभिक्रिया–
● अधिकांश धातुएँ जल के साथ अभिक्रिया करके हाडड्रोक्साइड बनाती है।
● हाइड्रोक्साइड क्षारकीय प्रकृति के होते हैं।
● सोडियम और पोटैशियम ठंडे जल से क्रिया करते हैं।
2Na+2H2O → 2NaOH +H2
2K +2H2O → 2KOH + H2
● जबकि मैग्नीशियम गर्म जल से क्रिया करता है –
Mg+2H2O → Mg → Mg(OH)2 +H2
● इनके अतिरिक्त एल्यूमिनियम या आयरन गर्म पानी अथवा भाप के साथ क्रिया करके धातु ऑक्साइड बनाते हैं–
2Al +3H2O → Al2O3+3H2
भाप
Fe +4H2O → Fe2O4 +4H2
भाप
धातुओं की आम क्षारकों के साथ अभिक्रिया –
● Sn एवं Zn धातु आम क्षारकों के साथ क्रिया करते हैं–
Sn+2NaOH +H2O→ Na2SnO3+2H2
सोडियम स्टेनेट
Zn+2NaOH → Na2 ZnO2+H2
सोडियम जिंकेट
● संक्षारण –धातु हवा के साथ अभिक्रिया करके ऑक्साइड बनाते हैं।
● धातुओं की इन ऑक्साइड बनाने की प्रवृति के कारण ही इनके (धातुओं) भौतिक एवं रासायनिक गुणों को क्षति पहुँचती है।
● धातुओं (आयरन) से निर्मित अनेक वस्तुओं जैसे-लौहे के दरवाजे, जालियाँ, कील आदि पर जंग लगना भी लोहे के ऑक्सीकरण से होता है।
● ऑक्सीकरण जिससे कॉपर ऑक्साइड बनता है जो अंत में ऑक्सीकरण की क्रिया द्वारा कॉपर कार्बोनेट में परिवर्तित हो जाता है।
● धातुओं के इस प्रकार के ऑक्सीकरण की प्रक्रिया को संक्षारण कहते हैं।
● संक्षारण के कारण ही धातु की सतह हवा एवं नमी के संपर्क में आने पर नष्ट हो जाती है।
● जंग लगने की क्रिया अधिकांशत: वर्षा ऋतु में होती है, क्योंकि उस समय हवा में नमी अधिक होती हैं।
❒ धातुओं के उपयोग–
● जिंक, लेड, पारा, लिथियम सैल और बैटरी बनाने में प्रयोग किया जाता है।
● सोना, चाँदी और प्लेटिनम धातु अपनी आघातवर्धनीयता, चमक और निष्क्रिय स्वभाव के कारण गहने बनाने में प्रयोग ली जाती है।
● आघातवर्धनीय धातुएँ जैसे की लोहा और एल्यूमिनियम से चादरें बनाई जाती हैं, जो अनेक निर्माण कार्यों में उपयोग में ली जाती है।
● अनेक धातुओं एवं अधातुओं के मिश्रधातु विभिन्न उद्देश्यों के लिए उपयोग में आते हैं, जैसे-स्टेनलैस स्टील बर्तन बनाने में।
● लोहा एवं स्टील मशीन बनाने में प्रयोग किए जाते हैं।
● तन्य धातुएँ जैसे-कॉपर तथा एल्यूमिनियम बिजली के तार बनाने में, स्टील से बनी रस्सी, क्रेन से भारी सामान उठाने और पुल बनाने में प्रयोग की जाती है।
❒ महत्वपूर्ण धातुएँ एवं उनके यौगिक –
1. सोडियम–
प्रतीक चिह्न-Na
परमाणु क्रमांक -11
परमाणु भार -23
अवस्थिति – समूह 1, आवर्त 3, ब्लॉक-s
इलेक्ट्रॉनिक विन्यास-1s2,2s2,2P6,3s1
● सोडियम उच्च क्रियाशीलता के कारण हमेशा संयुक्त अवस्था में पाया जाता है।
● संयुक्त अवस्था में सोडियम क्लारोइड, नाइट्रेट, कार्बोनेट, बोरेट एवं सल्फेट के रूप में पाई जाता है।
❒ सोडियम के प्रमुख अयस्क –
i. बॉरेक्स – Na2B4O7.10H2O
ii. सोडियम क्लोराइड –NaCl
iii. सोडियम सल्फेट या ग्लाबर सॉल्ट – Na2SO4.10H2O
iv. चिली साल्टपीटर – NaNO3
● सोडियम धातु का निष्कर्षण ‘कास्टनर’ विधि द्वारा गलित सोडियम हाइड्रॉक्साइड के विद्युत अपघटन द्वारा किया जाता है।
● इसके अतिरिक्त डाउन विधि के माध्यम से भी द्रवित सोडियम क्लोराइड के विद्युत अपघटन द्वारा इसे प्राप्त किया जाता है।
❒ गुण–
● सोडियम चांदी के समान सफेद, हल्की एवं मुलायम होती है।
● सोडियम विद्युत का सुचालक है।
● सोडियम का आपेक्षित धनत्व 0.97 है। यह जल से हल्का होने के कारण इसकी सतह पर तैरता है।
● सोडियम धातु जल के साथ क्रिया कर सोडियम हाइड्राक्साइड (NaOH) एवं हाइड्रोजन गैस (H2) का निर्माण करता है।
● यह अधिक क्रियाशील होने के कारण नम वायु से अभिक्रिया कर सोडियम ऑक्साइड (Na2O) का निर्माण करता है।
● सोडियम को क्लोरीन गैस में जलाने पर यह सोडियम क्लोराइड बनाता है, जबकि कार्बन डाइऑक्साइड के साथ जलाने पर सोडियम कार्बोनेट बनता है।
● सोडियम अम्लों से अभिक्रिया कर लवण बनाता है, जिससे हाइड्रोजन गैस मुक्त होती है।
● एल्कोहॉल के साथ अभिक्रिया कराने पर सोडियम एल्कॉक्साइड बनाता है। इस प्रक्रिया में हाइड्रोजन गैस मुक्त होती है।
● सोडियम बेंजीन में विलेय है।
● उपयोग– द्रवित सोडियम धातु का उपयोग नाभिकीय रिएक्टरों में शीतलक के रूप में।
● अपचायक के रूप में।
● सोडियम लेड मिश्र धातु का प्रयोग टेट्राइथाइल लेड (TEL) नामक अपस्फोटनरोधी (Anti knocking) बनाने में।
● मिश्रधातु बनाने तथा एंटीस्केलिंग के रूप में।
❒ सोडियम के यौगिक –
i. सोडियम कार्बोनेट – Na2CO3
● सोडियम कार्बोनेट डेकाहाइड्रेट Na2CO3.10H2O को सामान्यत: धावन या वाशिंग सोडा भी कहा जाता है।
● निर्जल सोडियम कार्बोनेट सोडा है।
● वाशिंग सोडा का जलीय विलियन क्षारीय होने के कारण इसमें अपमार्जक के गुण भी पाए जाते हैं।
● सोडियम कार्बोनेट का उत्पादन सौल्वे विधि (अमोनिया-सोडा विधि), विद्युत विधि तथा लेब्लांक विधि द्वारा किया जाता है।
उपयोग –
● मुख्य रूप से जल का खारापन दूर करने में होता है।
● प्रयोगशाला में अभिकर्मक के रूप में।
● पेट्रोलियम को शुद्ध करने में।
● काँच, साबुन, कागज, बॉरेक्स, कॉस्टिक सोडा तथा पेंट के निर्माण में।
● वस्त्र उद्योग में भी अभिकर्मक के रूप में इसका उपयोग किया जाता है।
ii. सोडियम हाइड्रॉक्साइड – NaOH
● यह कॉस्टिक सोड या दाहक सोडा भी कहलाता है।
उपयोग –
● प्रयोगशाला में अभिकर्मक के रूप में।
● पेट्रोलियम को शुद्ध करने में।
● साबुन, अपमार्जक एवं लवणों के उत्पादन में।
● सूती कपड़ों में चमक पैदा करने में तथा कृत्रिम रेशम के निर्माण में।
● रंग तथा रेयॉन निर्माण में।
● सोडियम के निष्कर्षण में तथा बॉक्साइट खनिज के शोधन में।
iii. सोडियम क्लोराइड – NaCl
● यह साधारण नमक या टेबल सॉल्ट के नाम से भी जाना जाता है।
● समुद्री जल की वाष्पीकरण प्रक्रिया द्वारा सोडियम क्लोराइड को प्राप्त किया जाता है।
● NaCl को खुली हवा में रखने पर यह हवा से नमी को ग्रहण कर लेता है। इसका मुख्य कारण NaCl में अशुद्धि के रूप में उपस्थित मैग्नीशियम क्लोराइड (MgCl2) है, जो प्रस्वेदी (Deliquence) होता है।
● डिहाइड्रेशन के समय शरीर में सोडियम क्लोराइड की मात्रा कम हो जाती है।
उपयोग –
● सोडियम क्लोराइड मानव भोजन का एक आवश्यक घटक है।
● बर्फ के साथ हिम-मिश्रण (Freezing Mixture) के रूप में।
● अचार, माँस, मछली के परिरक्षण में
iv. सोडियम बाइकोर्बोनेट – NaHCO3
● यह बेकिंग सोडा, खाने का सोडा तथा ब्रेड सोडा भी कहलाता है।
उपयोग –
● औषधि के रूप में, पेट की अम्लता दूर करने में।
● बेकिंग पाउडर बनाने में तथा सोडा-एसिड अग्निशामकों यंत्रों में।
● आटे में इसको मिलाने पर रोटी अच्छे से फूलती है क्योंकि इस समय कार्बन-डाई ऑक्साइड (CO2) गैस निकलती है।
● केक एवं अन्य भोज्य पदार्थों में भी इसका उपयोग किया जाता है।
v. सोडियम परऑक्साइड – Na2O2
● सामान्यत: यह हल्के पीले रंग का चूर्ण होता है, लेकिन खुली हवा में रखने पर यह हाइड्रॉक्साइड और कार्बोनेट की सतह जमने के कारण सफेद हो जाता है ।
उपयोग –
● पनडुब्बी, जहाज तथा अस्पताल के अंदर के वातावरण को शुद्ध करने में।
● रेशम तथा ऊन के विरंजन में।
● हाइड्रोजन परॉक्साइड के निर्माण तथा रंगाई में ऑक्सीकारक के रूप में।
vi. सोडियम सल्फेट – Na2SO4.10H2O
● यह ग्लोबर साल्ट भी कहलाता है।
● इसे सोडियम हाइड्रॉक्साइड या सोडियम कार्बोनेट पर सल्फ्यूरिक अम्ल की अभिक्रिया से बनाया जाता है।
● ग्लोबर साल्ट रंगहीन तथा रवादार ठोस पदार्थ है।
उपयोग –
● सोडियम सल्फाइड के निर्माण में तथा निर्जलीकरण के रूप में।
● कागज, दवा तथा काँच के निर्माण में।
vii. सोडियम थायोसल्फेट – Na2S2O3. 5H2O
● यह ‘हाइपो’ (HypO) भी कहलाता है।
● इसे सोडियम सल्फेट एवं सल्फर के जलीय विलयन की अभिक्रिया हाइड्रॉक्साइड के साथ करवाकर प्राप्त किया जाता है।
उपयोग –
● फोटोग्राफी में फिल्म के स्थायीकरण में।
● यह अनअपघटित सिल्वर ब्रोमाइड को विलेयशील सिल्वर थायोसल्फेट लवण के रूप में दूर करता है।
● सोना एवं चाँदी के निष्कर्षण में।
● गोलकृमि से बचाव में पैरों को साफ करने में।
● प्रतिक्लोर के रूप में।
viii. सोडियम नाइट्रेट – NaNO3
● यह ‘चिली साल्टपीटर’ भी कहलाता है।
● यह मुख्यत: नाइट्रिक अम्ल के निर्माण तथा उर्वरक के रूप में उपयोग किया जाता है।
● यह पेरू तथा चिली में बहुतायत में पाया जाता है।
ix. बोरेक्स –Na2 B4O7.10H2O
● इसका पूरा नाम सोडियम टेट्राबोरेट डेका हाइड्रेट है।
● यह सुहागा भी कहलाता है।
● बोरेक्स जल में विलेय, क्रिस्टलीय ठोस है।
उपयोग –
● जल को मृदु बनाने में।
● चमड़ा उद्योग में एवं चमड़े की रंगाई में।
● काँच, साबुन एवं मोमबत्ती उद्योग में।
x. माइक्रोकॉस्मिक लवण – Na(NH4)HPO4 .4H2O
● सोडियम अमोनियम हाइड्रोजन फॉस्फेट ही माइक्रोकॉस्मिक लवण कहलाता है।
● यह गर्म करने पर सोडियम मेटाफॉस्फेट एवं अमोनिया देता है।
● यह मानव मूत्र में पाया जाता है।
xi. केल्गन – [Na3 (PO3)6
● इसका पूरा नाम सोडियम हेक्सा मेटाफॉस्फेट है।
● यह मुख्य रूप से जल ही कठोरता दूर करने में उपयोग में लिया जाता है।
2. मैग्नीशियम एवं इसके यौगिक –
प्रतीक चिह्न-Mg
परमाणु क्रमांक -12
द्रव्यमान संख्या-24
अवस्थिति-समूह 2, आर्वत 3, ब्लॉक-s
इलेक्ट्रॉनिक विन्यास –1s2, 2s2, 2p6, 3s2
● मैग्नीशियम शब्द ग्रीक भाषा के शब्द मैग्नीशिया से लिया गया है।
● यह मैग्नीशियम सल्फेट के रूप में झरने में तथा मैग्नीशियम क्लोराइड के रूप में समुद्री जल में पाया जाता है।
● सोडियम के समान यह भी उच्च क्रियाशीलता के कारण स्वतंत्र अवस्था में नहीं पाया जाता है, अर्थात यह भी संयुक्त अवस्था में पाया जाता है।
● पौधों में हरे रंग के लिए जिम्मेदार ‘क्लोरोफिल’ में भी मैग्नीशियम पाया जाता है।
● मैग्नीशियम का निष्कर्षण मुख्यत: कार्नेलाइट (KCl.MgCl2.6H2O) अयस्क से किया जाता है, इसके अतिरिक्त मैग्नीशिया के विद्युत अपचयन द्वारा मैग्नेसाइट से तथा निर्जल मैग्नीशियम क्लोराइड के विद्युत अपघटन द्वारा भी किया जा सकता है।
❒ गुण –
● यह सफेद रंग की अत्यधिक चमकदार धातु है।
● मैग्नीशियम का क्वथनांक 1100 0C तथा गलनांक 650 0C है।
● मैग्नीशियम तनु अम्लों के साथ अभिक्रिया कर हाइड्रोजन गैस उत्पन्न करता है।
● मैग्नीशियम क्षारों के साथ किसी भी प्रकार की क्रिया नहीं करता है।
● यह अत्यधिक मुलायम, आघातवर्ध्य एवं तन्य धातु है।
● मैग्नीशियम शुष्क ईथर की उपस्थिति में इथाइल आयोडाइड से अभिक्रिया करके इथाइल मैग्नीशियम आयोडाइड बनाता है, जो ग्रिगनार्ड अभिकर्मक कहलाता है।
● तनु नाइट्रिक अम्ल से अभिक्रिया करके मैग्नीशियम नाइट्रेट बनाता है।
● मैग्नीशियम के प्रमुख अयस्क एवं मिश्रधातुएँ –
| धातु | अयस्क | रासायनिक सूत्र |
| मैग्नीशियम (Mg) | मैग्नेसाइट | MgCO3 |
| मैग्नीशियम (Mg) | एप्सम लवण | MgSO4. 7H2O |
| मैग्नीशियम (Mg) | डोलामाइट | MgCO3 .CaCO3 |
| मैग्नीशियम (Mg) | कार्नेलाइट | Kcl.MgCl2.6H2O |
❒ मिश्रधातुएँ –
i. ड्युरालुमिन (Duralumin) –
संघटन – Al+Mg+CU का अनुपात
95 : 1: 4
● इसका उपयोग प्रेशर कूकर तथा वायुयान का ढाँचा बनाने में।
ii. मैग्नेलियम (Magnalium) –
संघटन – Al+Mg का अनुपात
95 : 5 है
● इसका उपयोग वायुयान का ढाँचा बनाने में।
उपयोग – मिश्र धातुओं का निर्माण करने में।
● फोटोग्राफी एवं आतिशबाजी में।
● फ्लैश लाइट रिबन बनाने में।
● ग्रिग्नार्ड अभिकर्मक के रूप में।
❒ मैग्नीशियम के यौगिक –
i. मैग्नीशियम कार्बोनेट (MgCO3) –
● यह जल में घुलनशील श्वेत ठोस पदार्थ है।
● यह प्रकृति में डोलोमाइट या मैग्नेसाइट (MgCO3. CaCO3) के रूप में पाया जाता है।
उपयोग –
● मैग्नीशियम एल्वा में दवा के रूप में
● पेट की अम्लीयता दूर करने में अर्थात प्रतिअम्ल के रूप में।
● छपाई, मंजन आदि में
ii. मैग्नीशियम हाइड्रॉक्साइड – Mg(OH)2
● यह मिल्क ऑफ मैग्नीशिया भी कहलाता है।
● यह श्वेत रंग का पदार्थ है जो जल में अल्प विलय है।
● मैग्नीशियम हाइड्रॉक्साइड को क्षार माना जाता है।
उपयोग –
● पेट की अम्लीयता दूर करने में।
● अपशिष्ट अम्लीय जल को उदासीन बनाने में।
● शीरा (Molasses) से चीनी के निष्कर्षण में।
● डैन्डर्फ के उपचार तथा कैप्सूल में।
iii. मैग्नीशियम सल्फेट – MgSO4
● यह रंगहीन क्रिस्टलीय ठोस पदार्थ है।
● यह प्रकृति में गर्म झरने में एप्सोमाइट या एप्सम लवण (MgSO4.7H2O) के रूप में पाया जाता है।
● मैग्नीशियम सल्फेट (ZnSO4) का समाकृतिक है।
उपयोग –
● दस्तावर (Purgative) के रूप में
● सीमेंट, माचिस तथा अग्निरोधी वस्त्र के निर्माण में
● ग्रीलो विधि से सल्फ्यूरिक अम्ल के निर्माण में प्लैटिनीकृत MgSO4 उत्प्रेरक के रूप में।
● चमड़ा उद्योग तथा रंगाई-छपाई में।
● कपास, पेंट तथा साबुन उद्योग में।
iv. मैग्नीशियम एल्वा – Mg (OH)2 2Mg CO3 3H2O
● इसका उपयोग प्रतिअम्ल के रूप में पेट की अम्लता दूर करने में किया जाता है।
● प्रसाधन सामग्री में।
● दंत मंजन के रूप में।
V. मैग्नीशिया – यह चूर्ण जैसा हल्के सफेद रंग का होता है।
● जल में अल्प विलेय होता है।
● मैग्नीशियम ऑक्साइड ही मैग्नीशिया कहलाता है।
● मैग्नीशिया प्रतिदीप्तिशील प्रकाश उत्पन्न करता है।
vi. सोरेल सीमेंट – MgCl2 .5MgO. nH2O
● इसका उपयोग काँच तथा चीनी मिट्टी के बर्तनों को मजबूत बनाने में किया जाता है।
3. एलुमिनियम एवं इसके यौगिक –
प्रतीक चिह्न – Al
परमाणु क्रमांक – 13
परमाणु भार – 27
अवस्थिति – समूह 13, आर्वत 3, ब्लॉक-P
इलेक्ट्रॉनिक विन्यास – 1s2, 2s2, 2p6,3s2 3p1
● यह भी प्रकृति में स्वतंत्र अवस्था में नहीं पाया जाता है।
● यह भू-पर्पटी में सबसे अधिक पाया जाने वाला धातु है।
● ऑक्सीजन एवं सिलिकन के बाद यह तीसरा तत्व है जो सर्वाधिक मात्रा में पाया जाता है।
● ऐलुमिनियम का मुख्य अयस्क बॉक्साइट (Al2O3.2H2O) है। यह ऐलुमिनियम के जलयोजित ऑक्साइड के रूप में उपस्थित होता है।
● ऐलुमिनियम संयुक्त अवस्था में बॉक्साइट (Al2O3.2H2O) क्रायोलाइट (Na3AlF6), फेल्सपार (K2O.Al2O3.6SiO2) तथा कोरण्डम (Al2O3) के रूप में पाया जाता है।
● इसका निष्कर्षण बॉक्साइट अयस्क से विद्युत अपघटन विधि द्वारा किया जाता है।
● बॉक्साइट का रासायनिक नाम हाइड्रेटेट एलुमिना है।
● गुण –
● ऐलुमिनियम आघातवर्ध्यनीय एवं तन्य धातु है।
● यह सिल्वर के समान चमकदार धातु है।
● ऐलुमिनियम का गलनांक 659.8 0C तथा क्वथनांक 22000C है।
● ऐलुमिनियम ऊष्मा तथा विद्युत का उत्तम सुचालक है।
● ऐलुमिनियम तनु हाइड्रोक्लोरिक अम्ल (HCl) के साथ क्रिया कर हाइड्रोजन गैस मुक्त करता है।
● सान्द्र सल्फ्यूरिक अम्ल (H2SO4) से क्रिया होने पर SO2 गैस मुक्त होती है।
● सोडियम हाइड्रॉक्साइड या पोटैशियम हाइड्रॉक्साइड के साथ क्रिया होने पर ऐलुमिनेट लवण बनता है तथा हाइड्रोजन गैस मुक्त होती है।
● ऐलुमिनियम नाइट्रोजन के साथ अभिक्रिया कर ऐलुमिनियम नाइट्राइट बनाता है।
● तथा हैलोजन से अभिक्रिया कर हैलाइड बनाता है।
एलुमीनियम की मिश्रधातुएँ –
| मिश्रधातु | संगठन | उपयोग |
| i. ऐलुमिनियम ब्रांज | CU+Al का अनुपात 90 : 10 | बर्तन तथा सिक्के निर्माण में |
| ii. मैग्नेलियम | Al+Mg का अनुपात 95:5 | वायुयान का ढाँचा बनाने में |
| iii. ड्यूरेलूमिन | Al+Mg+CU का अनुपात 95:1:4 | प्रेशर कूकर, वायुयान का ढाँचा बनाने में |
उपयोग –
● घरेलू बर्तन बनाने में।
● वर्क के रूप में मिठाई तथा सिगरेट की पैकिंग में।
● ऐलुमिनियम एवं इससे बनी मिश्रधातुएँ मुख्यत: वायुयान बनाने में प्रयुक्त होती है।
● ऐलुमिनियम से बने तार विद्युत संचालन में प्रयुक्त होते हैं।
❒ ऐलुमिनियम के यौगिक –
i. ऐलुमिनियम क्लोराइड (AlCl3) –
● इसे फ्रिडल क्राफ्ट अभिक्रिया में उत्प्रेरक के रूप में व्यापक स्तर पर प्रयोग किया जाता है।
● इसके अतिरिक्त गैसोलिन के उत्पादन में भी इसे उत्प्रेरक के रूप में प्रयोग किया जाता है।
● पेट्रोलियम के शोधन में।
● रबर तथा संश्लेषित बहुलकों के उत्पादन में।
ii. ऐलुमिना – यह जल में विलेयशील, सफेद चूर्ण होता है।
● ऐलुमिना प्रकृति में बॉक्साइट तथा कोरंडम रूप में पाया जाता है।
● ऐलुमिना उभयधर्मी ऑक्साइड होने के कारण अम्ल एवं क्षार दोनों से अभिक्रिया करता है।
उपयोग –
● ऐलुमिनियम धातु बनाने में।
● कृत्रिम रत्न बनाने में।
● उत्प्रेरक के रूप में।
● ऐलुमिनियम के अनेक लवणों के निर्माण में
iii.पोटाश एलम – K2SO4 .Al2 (SO4)3.24H2O
● इसे फिटकरी भी कहा जाता है।
● इसका रासायनिक नाम ‘पोटैशियम ऐलुमिनियम सल्फेट’ है।
● इसका उपयोग मुख्य रूप से रक्त बहाव को रोकने में किया जाता है।
● इसके अतिरिक्त चमड़ा एवं कागज उद्योग में तथा जल को मृदु बनाने में।
iv. ऐलुमिनियम कार्बाइड – Al4C3
● इसे मिथेनाइड भी कहते हैं।
● यह जल से अभिक्रिया करके मिथेन (CH4) गैस बनाता है।
v. ऐलुमिनियम सल्फेट – Al2(SO4)3.18H2O
● इसे हेयर साल्ट के नाम से भी जाना जाता है।
● ऐलुमिनियम सल्फेट से फिटकरी बनाई जाती है।
● इसका उपयोग वस्त्रों की रंगाई, छपाई में किया जाता है।
4. कैल्सियम एवं इसके यौगिक –
प्रतीक चिह्न – Ca
परमाणु क्रमांक – 20
परमाणु भार – 40
अवस्थिति– समूह 2, आर्वत 4, ब्लॉक–s
इलेक्ट्रॉन विन्यास– 1s2, 2s2, 2p6, 3s2, 3p6, 4s2
● कैल्सियम प्रकृति में स्वतंत्र अवस्था में नहीं पाया जाता है।
● कैल्सियम सल्फेट, फॉस्फेट, कार्बोनेट, सिलिकेट आदि यौगिकों के रूप में प्रकृति में पाया जाता है।
● कैल्सियम भू-पर्पटी में प्रचुर मात्रा में पाया जाता है।
● यह मुख्यत: अस्थियों, अण्डों के छिलके, मिट्टी तथा पौधे में पाया जाता है।
● कैल्सियम धातु का निष्कर्षण कैल्सियम क्लोराइड एवं कैल्सियम फ्लोराइड मिश्रण के विद्युत अपघटन से किया जाता है।
● कैल्सियम धातु के कुछ प्रमुख अयस्क – डोलोमाइट (CaCO3.MgCO3), जिप्सम (CaSO4.2H2O), लाइम (CaCO3), फ्लोरस्पार (CaF2), फॉस्फोराइट (Ca3PO4) आदि।
❒ गुण –
● कैल्सियम चाँदी के समान सफेद, अन्य सामान्य धातुओं की अपेक्षा मुलायम लेकिन सीसे की तुलना में कठोर धातु है।
● कैल्सियम का गलनांक 842 0C तथा क्वथनांक 1484 0C होता है।
● कैल्सियम का आपेक्षिक 1.55 है।
● कैल्सियम ऊष्मा एवं विद्युत का सुचालक होता है।
● कैल्सियम अम्ल एवं जल के साथ क्रिया होने पर हाइड्रोजन गैस देता है, जबकि क्षारक के साथ नहीं।
उपयोग –
● धातुओं के निष्कर्षण में।
● स्टील, कॉपर तथा कास्ट आयरन को विऑक्सीकृत करने में।
● एल्कोहॉल में उपस्थित जल को हटाने में।
● क्रोमियम तथा थोरियम के अपचायक के रूप में।
❒ कैल्सियम के यौगिक –
i. कैल्सियम ऑक्साइड – CaO
● इसे क्विक लाइम भी कहा जाता है।
● यह जल में शीघ्रता से घुलकर कैल्सियम हाइड्रॉक्साइड बनाता है।
● उपयोग – लाइम प्रकाश उत्पन्न करने में, चीनी के शोधन में।
● रंजकों एवं अन्य रसायन के उत्पादन में।
● ब्लीचिंग पाउडर, काँच एवं क्षारों के उत्पादन में।
ii. कैल्सियम हाइड्रॉक्साइड – Ca(OH)2
● इसे बुझा हुआ चूना कहते हैं।
● इसे बिना बुझे चूने में जल मिलाकर प्राप्त किया जाता है।
● इसका जलीय विलयन ‘लाइम वाटर’ तथा बुझे चूने का निलम्बन ‘मिल्क ऑफ लाइम’ कहलाता है।
● शुष्क बुझे चूने के ऊपर क्लोरीन गैस प्रवाहित करने पर ब्लीचिंग पाउडर प्राप्त होता है।
● इसका उपयोग ब्लीचिंग पाउडर, सीमेंट, शीशा, कास्टिक सोडा आदि बनाने में किया जाता है।
iii. कैल्सियम क्लोराइड – CaCl2
● यह अल्प मात्रा में समुद्री जल में पाया जाता है।
● कैल्सियम क्लोराइड रंगहीन क्रिस्टलीय ठोस पदार्थ है।
● कैल्सियम क्लोराइड जल एवं एल्कोहॉल दोनों में विलेयशील होता है।
● इसका उपयोग जलशोषक के रूप में तथा हिम मिश्रण में किया जाता है।
iv. कैल्सियम कार्बोनेट –CaCO3
● यह सफेद रवेदार पाउडर है।
● कैल्सियम कार्बोनेट प्रकृति में चूना, पत्थर, खड़िया तथा मार्बल के रूप में पाया जाता है।
● यह डोलोमाइट के रूप में मैग्नीशियम कार्बोनेट के साथ पाया जाता है।
● इसका उपयोग दीवारों पर सफेदी, दंत मंजन, पेस्ट आदि बनाने में किया जाता है।
● संगमरमर के रूप में भी इसका उपयोग होता है।
v. विरंजक चूर्ण – Ca(OCl)Cl
● यह कैल्सियम का ऑक्सीक्लोराइड है।
● ठोस बुझे हुए चूने में क्लोरीन गैस प्रवाहित करके इसे प्राप्त किया जाता है।
● यह श्वेत चूर्ण रूप में होता है, जिससे क्लोरीन जैसी गंध आती रहती है।
● इसका उपयोग कीटाणुनाशक, कीटनाशी, विसंक्रामी के रूप में तथा जल के शुद्धिकरण में किया जाता है।
vi. जिप्सम – CaSO4 .2H2O
● यह सफेद रवेदार ठोस पदार्थ है।
● कैल्सियम सल्फेट ही जिप्सम कहलाता है।
● इसके एक अणु में जल के दो अणु क्रिस्टलन जल के रूप में पाए जाते हैं।
● जिप्सम को 120 0C पर गर्म करने पर यह प्लास्टर ऑफ पेरिस में परिवर्तत हो जाता है।
● इसका उपयोग प्लास्टर ऑफ पेरिस तथा अमोनियम सल्फेट उर्वरक बनाने में किया जाता है।
vii. प्लास्टर ऑफ पेरिस – CaSO4.12H2O
● अर्द्धजलयोजित कैल्सियम सल्फेट ही सामान्यत: पेरिस ऑफ प्लास्टर कहलाता हैं।
● यह जल के साथ शीघ्रता से क्रिया करता है।
● प्लास्टर ऑफ पेरिस का बनना ऊष्माक्षेपी प्रक्रम है।
● इसका उपयोग टूटी हडि्डयों पर प्लास्टर में, दंत चिकित्सा में तथा मूर्तियाँ बनाने में किया जाता है।
viii. सुपरफॉस्फेट ऑफ लाइम –
CaH4(PO4)2+CaSO4. 2H2O
● कैल्सियम हाइड्रोजन फॉस्फेट एवं कैल्सियम सल्फेट का मिश्रण ही ‘सुपरफॉस्फेट ऑफ लाइम’ कहलाता है।
● इसका निर्माण फॉस्फोराइट खनिज एवं जानवरों की हडि्डयों से किया जाता है।
● यह जल में शीघ्रता से घुल जाता है जिस कारण पौधे इसे आसानी से ग्रहण करते हैं, अत: इसका उपयोग उवर्रकों के रूप में किया जाता हैं।
● कैल्सियम कार्बाइड, नाइट्रोलिम, हाइड्रोलिथ तथा कैल्सियम फॉस्फेट भी कैल्सियम के यौगिक के रूप में पाए जाते हैं।
5. मैगनीज एवं इसके यौगिक –
प्रतीक चिह्न – Mn
परमाणु क्रमांक –25
परमाणु भार – 55
अवस्थिति – समूह 7, आर्वत 4, ब्लॉक d
इलेक्ट्रॉनिक विन्यास – [Ar] 3d5, 4s2
● शुद्ध मैगनीज धातु चाँदी के समान सफेद होती है।
● मैगनीज का निष्कर्षण पाइरोलुसाइट अयस्क से कार्बन अपचयन द्वारा किया जाता है।
❖ मैगनीज के यौगिक –
❒ पोटेशियम परमैंगनेट – KMnO4
● इसे लाल दवा के नाम से भी जाना जाता है।
● यह परमैंगनिक अम्ल (HMnO4) का पोटेशियम लवण है।
● यह जल में विलेयशील है। इसकी विलेयता ताप बढ़ने के साथ ही बढ़ती है। इसका विलयन गुलाबी रंग का होता है।
● औद्योगिक स्तर पर इसका उत्पादन पाइरोलुसाइट से किया जाता है।
उपयोग –
● प्रयोगशाला में तथा ऑक्सीकारक के रूप में।
● कार्बनिक यौगिकों में द्विबंधन की जाँच में।
● रेशमी, सूती एवं ऊनी कपड़ों के विरंजन में।
● तेलों को रंगहीन बनाने में।
6. आयरन एवं इसके यौगिक –
प्रतीक चिह्न – Fe
परमाणु क्रमांक – 26
परमाणु भार – 56
अवस्थिति– समूह 8, आर्वत 4, ब्लॉक –d
इलेक्ट्रॉन विन्यास – 1s2,2s2, 2p6,3s2,3p6, 3d6,4s2
● आयरन संक्रमण धातु है।
● यह प्रकृति में सबसे अधिक पाया जाने वाला चतुर्थ यौगिक है।
● यह स्वतंत्र अवस्था में नहीं पाया जाता है।
● आयरन मुक्त अवस्था में ब्राउन हेमेटाइट (2Fe2O3.H2O), लाल हेमेटाइट (Fe2O3) तथा मैगनेटाइट (Fe3O4) के रूप में पाया जाता है।
● यहाँ लाल हेमेटाइट अयस्क (Fe2O3) से आयरन का निष्कर्षण किया जाता है। जबकि मैग्नेटाइट लोहे का चुम्बकीय अयस्क है।
● आयरन मुख्यत: तीन प्रकार की किस्मों के रूप में पाया जाता है–
i. ढलवाँ लोहा (Cast Iron) –
● यह सबसे निम्नतम गुणवत्ता वाला आयरन है।
● इसमें कार्बन की मात्रा अन्य की तुलना में अधिक लगभग (2.5%) होती है।
● ढलवाँ आयरन कठोर एवं भंगुर प्रकृति का होता है।
● इसमें अशुद्धियों के रूप में सिलिकन (si), मैगनीज (Mn) तथा फॉस्फोरस (P) यौगिक पाए जाते हैं।
● ढलवाँ आयरन दो रूपों – सफेद ढलवाँ आयरन एवं भूरा ढलवाँ आयरन में पाया जाता है।
उपयोग –मुख्यत: ढलाई एवं रेल की पटरी में।
● बिजली के खम्भे तथा स्टील और पिटवाँ लोहा बनाने में भी इसका उपयोग होता है।
ii. पिटवाँ लोहा (Wrought Iron) – यह ढलवाँ लोहे से प्राप्त किया जाता है।
● ढलवाँ लोहे की तुलना में यह शुद्ध होता है।
● इसमें कार्बन की मात्रा अत्यंत कम लगभग 0.12 से 0.25% होती है।
● यह आघातवर्ध्य, कठोर एवं तन्य होता है।
● इसका उपयोग मुख्यत: तार, छड़, बोल्ट आदि बनाने में किया जाता है।
iii. इस्पात (Steel) –
● इस्पात कार्बन एवं आयरन से बनी मिश्रधातु है।
● इस्पात में कार्बन की मात्रा 0.25 से 1.5% तक होती है।
● इसका उपयोग मृदु इस्पात, मध्य इस्पात एवं कठोर इस्पात बनाने में दिया जाता है।
❒ आयरन के गुण –
● यह आघातवर्ध्य एवं तन्य होता है।
● आयरन में चुम्बकीय गुण पाया जाता है।
● आयरन का गलनांक 1533 0C एवं क्वथनांक 2450 0C है।
● शुद्ध आयरन की शुद्ध जल के साथ कोई अभिक्रिया नहीं होती है, लेकिन सामान्य जल के संपर्क में आने पर जंग लगता है।
● इसी प्रकार यह शुष्क हवा से अभिक्रिया नहीं करता है, लेकिन आर्द्र हवा के संपर्क से इस पर जंग लगता है।
● लाल तप्त आयरन पर भाप प्रवाहित करने पर यह H2 गैस उत्पन्न करता है।
● आयरन ठंडे एवं तनु HNO3 से अभिक्रिया करके फेरस नाइट्रेट एवं अमोनियम नाइट्रेट बनाता है।
❒ आयरन के यौगिक –
i. फेरस सल्फेट –FeSO4.7H2O
● यह हरा कसीस (green vitrial) भी कहलाता है।
● यह जल में शीघ्र घुलनशील, हरा क्रिस्टलीय ठोस है।
● यह इप्सम लवण का समाकृतिक है।
उपयोग –
● विभिन्न तरह की स्याही एवं मोहर लवण बनाने में।
● आयरन युक्त दवा बनाने में
● रंग उद्योग में तथा कृषि में कीटनशक के रूप में।
ii. फेरिक फ्लोराइड – FeCl3
● यह जल में घुलनशील होता है।
● इसका उपयोग चोटग्रस्त स्थान से रक्त के बहाव को रोकने में।
● इसे दवा के रूप में भी उपयोग किया जाता है।
iii. आयरन ऑक्साइड – FeO या Fe2O3
● यहाँ FeO फेरस ऑक्साइड तथा Fe2O3 फेरिक ऑक्साइड है।
● फेरिक ऑक्साइड ’जौहरी रूज’ भी कहलाता है।
iv. आयरन सल्फाइड – FeS
● इसे बेवकूफों का सोना भी कहा जाता है।
● इसका उपयोग प्रयोगशाला में हाइड्रोजन सल्फाइड गैस बनाने में किया जाता है।
v. मोहर लवण – FeSO4 (NH4) SO4. 6H2O
● मोहर लवण अर्थात फेरस अमोनियम सल्फेट होता है।
● यह जल में विलेय तथा एल्कोहॉल में अविलेय होता है।
उपयोग –
● अपचायक के रूप में।
● नीली स्याही बनाने में।
● चमड़े एवं वस्त्रों की रंगाई में।
● कीटनाशकों के निर्माण एवं रंगीन क्षार मूलकों के परीक्षण में किया जाता है।
7. कॉपर एवं इसके यौगिक –
प्रतीक चिह्न – CU
परमाणु क्रमांक – 29
परमाणु भार – 63.54
अवस्थिति – समूह 11, आर्वत 4, ब्लॉक d
इलेक्ट्रॉन विन्यास – [Ar] 3d11 4s1
● कॉपर एक संक्रमण धातु है।
● यह उत्कृष्ट धातु कहलाता है।
● कॉपर सिल्वर एवं गोल्ड के साथ सिक्का धातु या मुद्रा धातु कहलाता है।
● कॉपर प्रकृति में स्वतंत्र एवं संयुक्त दोनों अवस्थाओं में पाया जाता है।
● संयुक्त अवस्था में कॉपर सल्फाइड, ऑक्साइड एवं कार्बोनेट अयस्कों के रूप में पाया जाता है।
● कॉपर का निष्कर्षण मुख्यत: कॉपर पायराइट्स अयस्क से ‘फेन प्लवन विधि’ द्वारा किया जाता है।
❒ गुण –
● यह लाल नारंगी रंग की धातु है।
● कॉपर ऊष्मा एवं विद्युत का अच्छा सुचालक है।
● कॉपर का गलनांक 1083 0C तथा क्वथनांक 2310 0C है।
● कॉपर का घनत्व लगभग 8.95 gm cm-3 होता है।
● जब गर्म कॉपर पर HNO3 की वाष्प प्रवाहित की जाती है तो नाइट्रोजन गैस मुक्त होती है।
● कॉपर सामान्यत: शुष्क हवा से क्रिया नहीं करता है, लेकिन नम हवा से क्रिया करते हुए यह भास्मिक कार्बोनेट उत्पन्न करता है।
● कॉपर सान्द्र HCl से क्रिया कर क्यूप्रिक क्लोराइड बनाता है, जबकि यह तनु HCl से कोई क्रिया नहीं करता है।
● इसी प्रकार कॉपर तनु एवं ठंडे H2SO4 से भी क्रिया नहीं करता है, लेकिन सान्द्र H2SO4 के साथ क्रिया करते हुए SO2 गैस मुक्त करता है।
उपयोग – सिक्के एवं मिश्रधातु बनाने में।
● विद्युत लेपन एवं विद्युत मुद्रण में।
● विद्युत तार एवं विद्युत उपकरण में।
● कॉपर श्वसन एन्जाइम कॉम्पलेक्स, साइटोक्रोम C ऑक्सीडेज का मुख्य घटक है।
❒ कॉपर के यौगिक –
i. कॉपर सल्फेट – CuSO4
● यह नीला थोथा या नीला कसीस भी कहलाता है।
● कॉपर सल्फेट नीले रंग का रवेदार ठोस पदार्थ है।
● यह जल में अत्यधिक घुलनशील है।
● कॉपर का जलीय विलयन अम्लीय है अत: यह विषैला होता है।
● इस कारण इसका कीटाणुनाशक के रूप में उपयोग किया जाता है।
● यह पोटैशियम सायनाइड के साथ अभिक्रिया कर जटिल यौगिक पोटैशियम क्यूप्रोसायनाइड बनाता है।
उपयोग –
● विद्युत लेपन एवं विद्युत सेलों में।
● हरा रंजक बनाने में।
● कॉपर के शुद्धिकरण में।
ii. क्यूप्रस ऑक्साइड – Cu₂O
● कॉपर के चूर्ण को क्यूप्रिक ऑक्साइड के साथ गर्म करके इसे प्राप्त किया जाता है।
● यह जल में अविलेय, लाल रंग का ठोस पदार्थ है।
● इसका उपयोग रंग तथा रूबी काँच बनाने में किया जाता है।
iii. क्यूप्रिक क्लोराइड – CuCl2
● यह जल में विलेयशील है।
● इसका उपयोग मुख्यत: उत्प्रेरक के रूप में (डीकेन विधि द्वारा क्लोरिन के निर्माण में) किया जाता है।
iv. रोल्ड गोल्ड – यह कॉपर से बनी मिश्रधातु है। इसका उपयोग सस्ते आभूषण बनाने में किया जाता है।
नोट – कॉपर की मानव शरीर में अत्यधिक वृद्धि होने पर ‘विल्सन रोग’ हो जाता है।
8. सिल्वर एवं इसके यौगिक –
प्रतीक चिह्न – Ag
परमाणु क्रमांक – 47
परमाणु भार –118
अवस्थिति – समूह 11,आर्वत 5, ब्लॉकd
इलेक्ट्रॉन विन्यास–1s2,2s2, 2p6, 3s2, 3p6, 3d11, 4s2, 4p6, 4d11, 5s1
● सिल्वर प्रकृति में स्वतंत्र एवं संयुक्त दोनों अवस्थाओं में पाई जाती है।
● सिल्वर चमकदार, श्वेत तथा नरम संक्रमण धातु है।
● सिल्वर अत्यधिक आघातवर्ध्य एवं तन्य धातु है।
● सिल्वर के कुछ प्रमुख अयस्क हॉर्न सिल्वर (AgCl), रूबी सिल्वर या पाइरारगाइराइट (3Ag2S.Sb2S3) तथा सिल्वर ग्लांस (Ag2S) है।
● सिल्वर का निष्कर्षण अर्जेण्टाइट अयस्क से मैक आर्थर सायनाइड विधि द्वारा किया जाता है।
❒ गुण –
● सिल्वर ऊष्मा एवं विद्युत का श्रेष्ठतम चालक है।
● धातुओं में सिल्वर सबसे अच्छा सुचालक होता है।
● इसके आघातवर्ध्यनीय गुण के कारण इसके आभूषण बनाए जाते हैं।
● सिल्वर का गलनांक लगभग 960 0C तथा क्वथनांक 1955 0C होता है।
● यह 50% तनु नाइट्रिक अम्ल के साथ नाइट्रिक ऑक्साइड गैस उत्पन्न करता है।
● यह सान्द्र सल्फ्यूरिक अम्ल के साथ गर्म करने पर SO2 गैस बनाता है, जबकि तनु सल्फ्यूरिक अम्ल के साथ कोई क्रिया नहीं करता है।
उपयोग –
● विद्युत लेपन तथा दर्पण की कलई करने में।
● आभूषण, बर्तन एवं सिक्के बनाने में।
● मिश्रधातु बनाने में।
● सिल्वर के वर्क का उपयोग औषधि निर्माण में।
● दाँतों के मध्य छिद्रों को भरने में।
❒ सिल्वर के यौगिक –
i. सिल्वर हेलाइड – सिल्वर हैलोजनों से अभिक्रिया करके सिल्वर हैलाइड बनाते हैं।
● सिल्वर हैलाइट जैसे – सिल्वर क्लोराइड (AgCl) फोटोक्रोमेटिक काँच बनाने में, सिल्वर आयोडाइड (AgI) कृत्रिम वर्षा में तथा सिल्वर ब्रोमाइड (AgBr) फोटोग्राफी में उपयोग में लिए जाते हैं।
ii. सिल्वर नाइट्रेट – AgNO3
● इसे लुनर कॉस्टिक भी कहते हैं।
● इसे सिल्वर की अभिक्रिया तनु एवं गर्म HNO3 के साथ करवाकर प्राप्त किया जाता है।
● यह रंगहीन, सफेद क्रिस्टलीय ठोस है।
● यह जल में शीघ्रता से घुल जाता है।
● इसका गलनांक 214 0C है।
● इसे रंगीन बोतलों में रखा जाता है क्योंकि यह सूर्य के प्रकाश में अपघटित हो जाता है।
उपयोग –
● इसका मुख्य उपयोग मतपत्र के ठप्पे की स्याही बनाने में होता है।
● प्रयोगशाला में अभिकर्मक के रूप में।
● धोबियों के द्वारा कपड़े पर चिह्न बनाने वाली स्याही में।
● बालों के रंजक बनाने तथा Ag के विद्युत लेपन में।
9. सोना (Gold) –
प्रतीक चिह्न –AU
परमाणु क्रमांक – 79
परमाणु भार –197
अवस्थिति – समूह –11, आर्वत–6, ब्लॉक–d
इलेक्ट्रॉन विन्यास– [Xe] 4f14 5d11 6s1
● सोना चमकीली पीली, नरम, धात्विक चमक वाली धातु है।
● यह प्रकृति में स्वतंत्र एवं संयुक्त अवस्था में कुछ अयस्कों के साथ पाया जाता है।
● यह सामान्यत: ‘क्वार्ट्ज’ के रूप में पाया जाता है।
● इसका निष्कर्षण केलावेराइट और सिल्वेनाइट अयस्कों से संपन्न होता है।
❒ गुण –
● यह कोमल तथा सबसे आघातवर्ध्य धातु है।
● सोना भी चाँदी के समान ऊष्मा एवं विद्युत का सुचालक होता है।
● इसका गलनांक लगभग 1064 0C तथा क्वथनांक लगभग 26000C है।
● सोना वायु के साथ-साथ क्षार के साथ भी किसी भी प्रकार से क्रिया नहीं करता है।
● यह पोटैशियम सायनाइड में घुलकर पोटैशियम ऑरोसायनाइड बनाता है।
उपयोग – मुख्यत: आभूषणों के निर्माण में।
● सिक्के बनाने तथा विद्युत लेपन में।
● इसके लवण फोटोग्राफी में।
● चीनी एवं औषधीय उद्योगों में।
❒ सोने के यौगिक –
i. आयरन पायराइट्स –यह मूर्खों का सोना एवं झूठा सोना कहलाता है।
ii. रोल्ड –गोल्ड – यह सोने का कृत्रिम रूप कहलाता है।
● यह कॉपर (90%) तथा एलुमिनियम (11%) का मिश्रण है।
● इसे सस्ते आभूषण में काम लिया जाता है।
iii. पर्पल ऑफ कैसियम – [Au+Sn(OH)4]
● यह पर्पल रंग का कोलाइडी सोना है।
● इसका उपयोग रासायनिक यौगिकों में सोने की उपस्थिति का पता लगाने तथा रूबी ग्लास बनाने में किया जाता है।
10. जिंक एवं इसके यौगिक –
प्रतीक चिह्न – Zn
परमाणु क्रमांक – 30
परमाणु भार – 65
अवस्थिति – समूह 12, आर्वत 4, ब्लॉक – d
इलेक्ट्रॉन विन्यास – 1s2, 2s2, 2p6, 3s2, 3p6, 3d11, 4s2
● यह भी संक्रमण धातु है।
● जिंक संयुक्त अवस्था में अनेक अयस्कों के साथ जैसे – जिंक ब्लैंड (Zns), जिंकाइट (ZnO) तथा कैलेमाइन (ZnCO3) के रूप में पाया जाता है।
● जिंक का निष्कर्षण सल्फाइड अयस्क ‘जिंक ब्लेड’ (Zns) से किया जाता है।
❒ गुण –
● जिंक नीला, श्वेत तथा भगुंर होता है।
● जिंक का गलनांक 419 °C तथा क्वथनांक 920 °C है।
● यह भी ऊष्मा एवं विद्युत का सुचालक है।
● यह सान्द्र NaOH या सान्द्र KOH घोल के साथ गर्म करने पर हाइड्रोजन गैस मुक्त करता है।
उपयोग –
● जिंक चूर्ण के रूप में प्रयोगशाला में।
● मिश्रधातुएँ तथा जस्तेदार लोहा बनाने में।
● चाँदी एवं सोने के निष्कर्षण में।
❒ जिंक के यौगिक –
i. जिंक सल्फेट – ZnSO4.7H2O
● यह सफेद थोथा या सफेद कसीस भी कहलाता है।
उपयोग
● जिंक लेपन में, विद्युत अपघटय के रूप में।
● रेयॉन के निर्माण में स्कंदक के रूप में तथा रंजकों में रंग बंधक के रूप में।
ii. जिंक ऑक्साइड – ZnO
● यह फिलॉस्फर ऊल भी कहलाता हैं।
● यह प्रकृति में जिंकाइट या लाल जिंक अयस्क के रूप में पाया जाता है।
उपयोग
● कृत्रिम दाँत बनाने में।
● मलहम तथा क्रीम बनाने में।
● यह रंगने में भी काम आता है।
iii. लिथोफोन – BaSO4+ZnS
● जिंक सल्फाइड तथा बेरियम सल्फेट का मिश्रण लिथोफोन कहलाता हैं।
● यह प्रकाश में धूसर रंग का तथा अँधेरे में सफेद रंग का हो जाता है।
● यह मुख्यत: रंगाई के कार्यों में प्रयुक्त किया जाता है।
● इनेमल बनाने में उपयोगी।
iv. जिंक फॉस्फाइड – Zn3P2
● इसे मूषकनाशी (Rat POisOn) में प्रयोग किया जाता है।
v. जिंक क्लोराइड – ZnCl2
● लकड़ी की वस्तुओं एवं सामग्री को कीड़ों से सुरक्षित रखने के लिए जिंक क्लोराइड का लेपन किया जाता है।
11. पारा एवं इसके यौगिक –
प्रतीक चिह्न – Hg
परमाणु क्रमांक – 80
परमाणु भार – 200
अवस्थिति – समूह 12, आर्वत 6, ब्लॉक–d
इलेक्ट्रॉन विन्यास – [Xe] 4f14, 5d11, 6s2
● पारा ‘क्विक सिल्वर’ भी कहलाता है।
● यह प्रकृति में सिनेबार अयस्क के रूप में पाया जाता है तथा इसका निष्कर्षण भी सिनेबार अयस्क से ही किया जाता है।
❒ गुण –
● यह पारा चाँदी के समान चमकीली एवं सफेद धातु है।
● यह सामान्यत: कमरे के ताप पर द्रव अवस्था में पाया जाता है।
● वसा एवं चीनी के मिश्रण के साथ इसे अत्यधिक जोर से हिलाने पर यह (पारा) भूरे रंग के चूर्ण में बदल जाता है। यह घटना पारे का मृतकीकरण (Deadening Of Mercury) कहलाती है।
● 4.12 K ताप पर पारे का विद्युतीय प्रतिरोध शून्य हो जाता है।
● यह सभी धातुओं (प्लेटिनम एवं आयरन को छोड़कर) के साथ मिलकर मिश्रधातु बनाता है।
● ये मिश्रधातु अमलगम कहलाते हैं।
● पारा तनु HCl एवं H2SO4, जल तथा क्षार के साथ किसी भी प्रकार की क्रिया नहीं करता है।
● पारा सल्फर के साथ अभिक्रिया कर मरक्यूरिक सल्फाइड बनाता है।
● जबकि क्लोरीन के साथ अभिक्रिया पर मरक्यूरिक क्लोराइड बनाता है।
● पारा ठंडे एवं तनु HNO3 तथा गर्म एवं सान्द्र HNO3 से अभिक्रिया करके क्रमश: मरक्यूरस नाइट्रेट [Hg2 (NO3)2] एवं NO तथा मरक्यूरिक नाइट्रेट एवं NO2 बनाता है।
उपयोग–
● थर्मामीटर, बेरोमीटर मे।
● धातुओं के अमलगम निर्माण में।
● सोना एवं चाँदी के निष्कर्षण में।
● मर्करी लैम्प, प्रदीपक लैम्प एवं ट्यूब लाइट में।
● सिंदूर निर्माण में।
● LCD स्क्रीन, बैटरियों तथा मापन युक्तियों में।
❒ पारा के यौगिक–
i. मरक्यूरिक क्लोराइड – HgCl2
● यह कोरोसिव सब्लिमेट के नाम से भी जाना जाता है।
● यह विषैला यौगिक है।
● यह गर्म जल में शीघ्रता से घुल जाता है जबकि लेकिन ठंडे जल में सामान्य घुलनशील।
उपयोग –
● कीटाणुनाशक के रूप में।
● सर्जिकल यंत्रों के विसंक्रमण में।
● चमड़ा पकाने, शुष्क बैटरी तथा टैक्सटाइल प्रिंटिंग में।
● मर्क्यूरिक लोशन तथा कैलोमल बनाने में।
ii. मरक्यूरस क्लोराइड – Hg2Cl2
● इसे केलोमल के नाम से भी जाना जाता है।
● यह तनु अम्ल तथा जल में अघुलनशील है।
● इसका उपयोग कैलोमल इलेक्ट्रोड तथा औषधि बनाने में भी किया जाता है।
iii. मरक्यूरिक सल्फाइड – HgS
● इसे वर्मीलियन के नाम से भी जाना जाता है।
● यह भी अम्ल तथा जल में अविलेय है।
● यह अम्लराज में घुलकर मरक्यूरिक क्लोराइड बनाता है।
● इसका उपयोग औषधि में मकरध्वज के रूप में, सिंदूर के रूप में तथा जल रंगों के निर्माण में किया जाता है।
12. लेड एवं इसके यौगिक –
प्रतीक चिह्न – Pb
परमाणु क्रमांक – 82
परमाणु भार – 207
अवस्थिति – समूह 14, आर्वत 6, ब्लॉक p
इलेक्ट्रॉन विन्यास – [Xe] 4f14, 5d11, 6s2, 6p2
● लेड सर्वाधिक स्थायी तत्व है।
● सामान्यत: यह संयुक्त अवस्था में पाई जाती है।
● लेड का निष्कर्षण अयस्क ‘गैलेना’ (PbS) से किया जाता है।
❒ गुण–
● लेड में धात्विक चमक पाई जाती है।
● यह भारी धातु है।
● लेड का गलनांक 327 °C तथा क्वथनांक 1620 °C है।
● यह विद्युत एवं ताप का कुचालक है।
● यह शुष्क वायु से तो क्रिया नहीं करता है, लेकिन नम वायु के साथ अभिक्रिया कर पहले हाइड्रॉक्साइड फिर कार्बोनेट बनाता है।
● लेड क्षार के साथ क्रिया करके प्लमबेट बनाती है। साथ ही हाइड्रोजन मुक्त करती है।
● तनु नाइट्रिक अम्ल से अभिक्रिया कर नाइट्रिक ऑक्साइड गैस मुक्त करता है।
उपयोग–
● लेड चेम्बर, लेड पाइप के निर्माण में।
● लेड-आर्सेनिक मिश्रधातु का उपयोग बुलेट बनाने में।
● नाभिकीय अनुसंधान में तथा कार्बन लेड का उपयोग कृत्रिम अंगों के निर्माण में।
❒ लैड के यौगिक
i. लेड ऑक्साइड – PbO
● इसे लिथार्ज भी कहा जाता है।
● यह उभयधर्मी ऑक्साइड है।
● इसका उपयोग लेड स्टोरेज बैटरी के निर्माण तथा फ्लिण्ट काँच के निर्माण में किया जाता है।
ii. लाल लेड – Pb3O4
● इसका रासायनिक नाम ट्राइप्लम्बिक टेट्रा ऑक्साइड है तथा सामान्य नाम सिंदूर है।
● इसका उपयोग लाल पेंट, लाल पेंसिल, दियासलाई बनाने में तथा सीमेंट निर्माण एवं काँच उद्योग में किया जाता है।
iii. लेड एसीटेट– Pb (CH3COO)2
● इसे लेड शर्करा या अकार्बनिक शर्करा भी कहते हैं।
● इसका उपयोग H2S गैस की उपस्थिति में किया जाता है।
iv. टेट्राएथिल लैड – Pb (C2H5)4
● यह पेट्रोल के अपस्फोटन को रोकता है। इस कारण इसे अपस्फोटनरोधी कारक कहते हैं।
13. यूरेनियम
प्रतीक चिह्न – U
परमाणु क्रमांक – 92
परमाणु भार – 238
अवस्थिति – समूह 3, आर्वत 7, ब्लॉक – f
इलेक्ट्रॉनिक विन्यास – [Rn] 5f3, 6d1, 7s2
● यह एक दुर्लभ तत्व है तथा प्रकृति में मुक्त रूप से नहीं पाया जाता है। पिचब्लैंड अयस्क से यूरेनियम धातु का निष्कर्षण किया जाता है।
● यूरेनियम 92�232, 92�233, 92�234, 92�235, 92�236 तथा 92�238 छ: समस्थानिक रूपों में पाया जाता है। इस सभी समस्थानिकों में से 92�238 प्रकृति में सर्वाधिक मात्रा में पाया जाता है।
● यूरेनियम को आशा धातु (Metal Of Hope) भी कहा जाता है।
❒ भौतिक गुण – यूरेनियम का गलनांक 1850 °C, क्वथनांक 3500 °C तथा
● आपेक्षिक घनत्व 19.05 होता है।
● इसके सभी समस्थानिक रेडियोसक्रिय होते हैं। यह बहुत तन्य तथा अघातवर्ध्य धातु है।
● यूरेनियम की अशुद्ध धातु भगुंर होती है। यह चाँदी की तरह सफेद चमकदार धातु है।
उपयोग
● 92�235 का उपयोग परमाणु भट्टी में ईधन के रूप में।
● हैबर विधि में उत्प्रेरक के रूप में।
● यूरेनियम के एसीटेट तथा नाइट्रेट का उपयोग फोटोग्राफी में।
● मिश्रधातुओं के निर्माण में।
● गैस विसर्जन उपकरण में इलेक्ट्रोड के रूप में।
● यूरेनियम के सेलिसायलेट, नाइट्रेट तथा क्लोराइड का उपयोग फोटोग्राफी में।
● नाभिकीय आयुधास्त्रों (मिसाइल, एटम बम आदि) के निर्माण में।
❒ अधातु (Non-Metal)
● ऐसे तत्व जो इलेक्ट्रॉन (इलेक्ट्रॉनों) को ग्रहण कर ऋणायन बनाते हैं, अधातु कहलाते हैं। अधातुओं को आधुनिक आवर्त सारणी में दायीं ओर रखा गया है।
अधातुओं के भौतिक गुणधर्म –
● ये ताप तथा विद्युत के कुचालक होते हैं। ग्रेफाइट अपवाद है।
● इन धातुओं के गलनांक तथा क्वथनांक कम होते हैं। कार्बन (ग्रेफाइट तथा हीरा) तथा बोरोन अपवाद है।
● ये प्राय: ठोस तथा गैस अवस्था में होती है। ब्रोमीन द्रव अवस्था में होती है, जो अपवाद है।
● अधातु विभिन्न रंग प्रदर्शित करती है।
● अधातुएँ चमकीली निनादी (sonorous), अघातवर्ध्य तथा तन्य होती है। आयोडीन अपवाद है, क्योंकि ये चमकीली होती हैं।
अधातुओं के रासायनिक गुणधर्म –
● अधातुएँ प्रकृति में विद्युत ऋणात्मक होते हैं अर्थात ये इलेक्ट्रॉन को ग्रहण कर ऋणायन बनाते हैं।
● अधातुएँ ऑक्सीजन के साथ क्रिया करके ऑक्साइड बनाते हैं तथा अधातुओं के ऑक्साइड प्राय: व्यवहार में अम्लीय होते हैं।
● अधातुओं की क्रिया क्षारों के साथ जटिल होती है।
● SO2, SO3, CO2, P2O5 आदि अधातुओं के ऑक्साइड अम्लीय तथा NO, H2O, CO तथा N2O अधातुओं के ऑक्साइड उदासीन होते हैं।
● अधातुएँ वायु में क्रियाशील हो सकती हैं जबकि प्राय: अधातुएँ जल से क्रिया नहीं करती, जैसे-फॉस्फोरस को वायु में खुला छोड़ने पर यह स्वत: जल जाता है। इसलिए इसे जल में रखा जाता है।
कुछ महत्वपूर्ण अधातुएँ–
1. हाइड्रोजन–
प्रतीक चिह्न – H
परमाणु क्रमांक-1
परमाणु भार – 1.008
अवस्थिति – ब्लॉक –s
इलेक्ट्रॉनिक विन्यास – 1s1
● इसकी खोज हेनरी कैवेंडिस ने 1766 ई. में की।
● हाइड्रोजन की कुछ विशेषताएँ हैलोजन तत्वों के समान होती है इसलिए इसे वर्ग 17 में भी रखा जाता है।
● इसके नाभिक में एक प्रोटॉन होता है तथा इसके नाभिक में न्यूट्रॉन नहीं होता है।
● इसे भविष्य का ईंधन भी कहते हैं।
● हाइड्रोजन की उपस्थिति – हाइड्रोजन असंयुक्त अवस्था में वायु में अल्प मात्रा में पाया जाता है। ऊपरी वायुमंडल में इसकी मात्रा अधिक पाई जाती है। हाइड्रोजन अम्लों का आवश्यक घटक है तथा क्षारों व कार्बनिक यौगिकों में भी पाया जाता है। हाइड्रोजन पृथ्वी पर संयुक्त अवस्था में जल, पेड़-पौधें, तेल, वसा, काष्ठ प्रत्येक जैविक पदार्थ आदि में उपस्थित होता है।
❒ निर्माण की विधि–
सोडियम तथा हाइड्रोलिथ की जल से प्रतिक्रिया करने पर हाइड्रोजन गैस प्राप्त होती है।
2Na+2H2O → 2NaOH+H2 ↑
CaH2+2H2O → Ca (OH)2 +H2↑
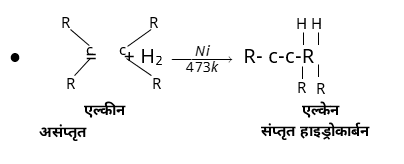
❍ तेलों का हाइड्रोजनीकरण– हाइड्रोजन वनस्पति तेलों से उच्च दाब तथा निकेल उत्प्ररेक की उपस्थिति में संयोग कर उन्हें वनस्पति घी में बदल देता है, इसी क्रिया को तेलों का हाइड्रोजनीकरण कहते हैं।
● वनस्पति तेल +H2 →��,473� वनस्पति घी
❒ हाइड्रोजन के उपयोग
● गैसोलिन के उपादन में।
● द्रव हाइड्रोजन रॉकेट ईंधन के रूप में।
● अन्य गैसों के साथ मिश्रित करके ईंधन के रूप में।
● अमोनिया के उत्पादन में।
● वनस्पति घी के निर्माण में।
● धातुओं को काटने में (ऑक्सीजन-हाइड्रोजन लौ के रूप में)
● हल्की होने के कारण बैलून में भरने में (हाइड्रोजन ज्वलनशील होने के कारण वर्तमान में हाडड्रोजन-हीलियम के मिश्रण का उपयोग करते हैं)
❒ हाडड्रोजन के रूप –
i. नवजात हाइड्रोजन (Nascent Hydrogen) – रासायनिक अभिक्रिया के फलस्वरूप निकली हाइड्रोजन गैस नवजात हाइड्रोजन कहलाती हैं।
ii. परमाण्विक हाइड्रोजन (Atomic Hydrogen) – हाइड्रोजन अणु के विघटन से जो हाइड्रोजन प्राप्त होती है, उसे परमाण्विक हाइड्रोजन कहते हैं।
iii. आर्थो हाइड्रोजन (Ortho Hydrogen) – जब हाइड्रोजन अणु के दोनों परमाणु के नाभिक एक ही दिशा में चक्रण करते हैं, तो हाइड्रोजन के ऐसे रूप को आर्थो हाइड्रोजन कहते हैं।
iv. पारा हाइड्रोजन (Para Hydrogen) –जब हाइड्रोजन अणु के दोनों परमाणु के नाभिक एक-दूसरे के विपरीत दिशा में चक्रण करते हैं। हाइड्रोजन के ऐसे रूप को पारा हाइड्रोजन कहते हैं।
❒ हाइड्रोजन के समस्थानिक – इसके तीन समस्थानिक होते हैं जो निम्नलिखित हैं –
● प्रोटियम (Protium) – प्रोटियम की परमाणु क्रमांक तथा द्रव्यमान क्रमांक 1 होती है। इसे 1H1 से प्रदर्शित करते हैं।
● ड्यूटेरियम (Deuterium) – ड्यूरेटिरयम की खोज 1931 में यूरे, ब्रिकवेड तथा मर्फी ने की। ड्यूटेरियम की परमाणु क्रमांक 1 तथा द्रव्यमान क्रमांक 2 होती है। इसे 1H2 या D द्वारा प्रदर्शित करते हैं। इसे भारी हाइड्रोजन भी कहते हैं। इसका उपयोग नाभिकीय प्रतिक्रियाओं में बमबारी के लिए तथा कार्बनिक प्रतिक्रियाओं की क्रियाविधि समझाने में होता है।
❒ ट्राइटियम (Tritium) – हाइड्रोजन के इस समस्थानिक द्वारा बीटा कण का उत्सर्जन होता है। यह एक दुर्लभ समस्थानिक है। इसकी परमाणु क्रमांक 1 तथा द्रव्यमान क्रमांक 3 होती है। इसे 1H3 या T द्वारा प्रदर्शित करते हैं।
❒ हाइड्रोजन परॉक्साइड (Hydrogen Peroxide) – इसकी खोज सन् 1818 में थेनार्ड ने की। इसका अणुसूत्र H2O2 होता है। थेनार्ड ने इसे ऑक्सीजिनेटेड वाटर कहा। यह प्रकृति में अल्प मात्रा में पाया जाता है तथा यह वर्षा जल, बर्फ, वायुमंडल आदि में मिलता है।
❒ विशेषताएँ –
● यह ऑक्सीकारक तथा अवकारक दोनों की तरह व्यवहार करता है।
● यह फीका, गंधहीन, गाढ़ा तथा नीला होता है।
● यह जल के समान एक संगुणित द्रव है क्योंकि इसमें हाइड्रोजन बंध पाया जाता है।
उपयोग
● पुराने तेल चित्रों (Oil Paintings) को चमकाने में।
● विरंजक के रूप में।
● बालों के ब्लीचिंग में।
● ईंधन के रूप में।
● शराब, दूध आदि का परिरक्षण करने में।
● घाव धोने, दाँत व कान साफ करने में, गरारे करने में।
❒ जल (Water) – जल एक यौगिक है तथा इसका अणुसूत्र H2O होता है।
● शुद्ध जल का pH का मान 7 होता है अर्थात यह उदासीन होता है। शुद्ध जल विद्युत का कुचालक तथा अम्लीय जल विद्युत का सुचालक होता है।
● शुद्ध जल का द्रवणांक 00C तथा क्वथनांक 1000C होता है। सर्वाधिक शुद्ध जल वर्षा का जल होता है। संपूर्ण जल का 97% भाग समुद्र में तथा 3% भाग स्वच्छ जल के रूप में पाया जाता है।
● जल का घनत्व 40C पर अधिकतम होता है तथा जल का आयतन 40C पर न्यूनतम होता है। 00C पर जल बर्फ में परिवर्तित हो जाता है।
● जल का बर्फ तथा वाष्प में परिवर्तन होना भौतिक परिवर्तन का उदाहरण है।
❒ जल के प्रकार –
● कठोर जल (Hard Water) – कठोर जल में कैल्सियम तथा मैग्नीशियम के सल्फेट, बाइकार्बोनेट तथा क्लोराइड घुले रहते हैं।
● यह साबुन के साथ झाग नहीं देता है।
● कठोर जल में घुले हुए लवण स्वास्थ्य के लिए हानिकारक होते हैं इसलिए यह पीने के उपयोगी नहीं होता है।
● मृदु जल (Soft Water) – यह जल पीने के लिए उपयोगी होता है तथा यह जल साबुन के साथ घुलकर आसानी से झाग देता है।
❒ जल की कठोरता (Hardness of water) –
● स्थायी कठोरता – जल में कैल्सियम व मैग्नीशियम के क्लोराइड तथा सल्फेट लवण के घुलने से उत्पन्न कठोरता, जल की स्थायी कठोरता कहलाती है।
● जल की स्थायी कठोरता दूर करने की मुख्य विधि परम्यूटिट विधि होती है।
● इसकी कठोरता को जल में सोडियम कार्बोनेट मिलाकर गर्म करने से भी दूर कर सकते हैं।
● अस्थायी कठोरता – जल में कैल्सियम व मैग्नीशियम के बाइकार्बोनेट्स लवण के घुलने से उत्पन्न कठोरता, जल की अस्थायी कठोरता कहलाती है।
● इस अस्थायी कठोरता को उबालकर दूर कर सकते हैं। जल की स्थायी तथा अस्थायी दोनों प्रकार की कठोरता को दूर करने के लिए जल में सोडियम कार्बोनेट डालकर उबाला जाता है।
● जल में कई पदार्थों को घुलाने की क्षमता होती है इसलिए जल को सार्वत्रिक विलायक कहते हैं।
● जल को उत्तम विलायक भी माना जाता है क्योंकि जल का डाईइलेक्ट्रिक नियतांक अधिक होता है। (अपवाद-कार्बनिक पदार्थ)
● भारी जल– यूरे तथा वाशबर्न ने भारी जल की खोज 1932 में की। ड्यूटेरियम के ऑक्साइड को भारी जल कहते हैं। ड्यूरेटियम हाइड्रोजन का भारी समस्थानिक होता है।
● भारी जल का अणुभार 20 होता है। इस जल का घनत्व साधारण जल के घनत्व से अधिक होता है।
उपयोग –
● मंदक के रूप में।
● ड्यूटेरियम के अनेक यौगिकों के निर्माण में।
2. कार्बन –
प्रतीक चिह्न – C
परमाणु क्रमांक-6
परमाणु भार – 12
अवस्थिति – वर्ग 14 या IV A
इलेक्ट्रॉनिक विन्यास – 1s22s2, 2p2
● कार्बन प्रकृति में मुक्त तथा संयुक्त दोनों ही अवस्थाओं में बहुतायत में पाया जाता है।
● मुक्त अवस्था में ग्रेफाइट, कोयला तथा हीरे के रूप में एवं संयुक्त अवस्था में CO2, प्रोटीन, कार्बोहाइड्रेट, कार्बोनेट, बाइकार्बोनेट्स, हाइड्रोकार्बन तथा अन्य जटिल यौगिकों के रूप में पाया जाता है।
❒ गुणधर्म –
● कार्बन में श्रृंखलन (Catenation) का गुण सबसे अधिक पाया जाता है।
● श्रृंखलन के कारण कार्बन के सर्वाधिक यौगिक है।
● कार्बन एक चर्तु:संयोजक धातु है।
● कार्बन स्वयं से तथा उच्च विद्युत ऋणात्मकता वाले अन्य परमाणुओं से बहुबंध बनाता है।
● कार्बन दोनों ही रूपों (रवेदार तथा बेरवेदार) में पाया जाता है।
● अपररूप (Allotropes) – किसी तत्व अथवा यौगिक का दो या दो से अधिक अपररूपों, जिनके भौतिक गुण भिन्न हो परन्तु रासायनिक गुण समान हो, में होना अपररूपता (allotropy) कहलाता है।
● कार्बन क्रिस्टलीय तथा अक्रिस्टलीय दोनों प्रकार के अपररूपों में पाया जाता है।
● क्रिस्टलीय रूप में हीरा, ग्रेफाइट तथा फुलरीन एवं अक्रिस्टलीय रूप में कोक, काष्ठ चारकोल, कोयला आदि हैं।
● हीरा (Diamond) – हीरा कार्बन का क्रिस्टलीय अपरूप है।
● यह प्रकृति में किम्बरलाइट पत्थर के रूप में पाया जाता है।
● विश्व में ‘दक्षिण अफ्रीका’ हीरे का सबसे अधिक उत्पादक देश है।
● हीरे की शुद्धता का मापन ‘कैरेट’ में किया जाता है।
1 कैरेट = 200 Mg
● शुद्ध हीरा पारदर्शक एवं रंगहीन होता है, लेकिन इसमें पाई जाने वाली अशुद्धियों के कारण यह कई रंगों में पाया जाता हैं।
● कुछ हीरे काले रंग में पाए जाते हैं, जिन्हें बोर्ट कहा जाता हैं।
● एक हीरे के क्रिस्टल में प्रत्येक कार्बन परमाणु चार अन्य कार्बन परमाणुओं से चतुष्फलकीय व्यवस्था में सह-संयोजक आबंध द्वारा जुड़कर दृढ़ त्रिविमीय जालक का निर्माण करते हैं।
● सह-संयोजक आबंधता के जाल द्वारा बनाई गई कार्बन परमाणु की त्रि-आयामी व्यवस्था हीरे को एक कठोर संरचना प्रदान करती है।
● यह दृढ़ता हीरे को अत्यधिक कठोर बनाती हैं। इस कारण हीरा पृथ्वी पर प्राकृतिक पदार्थों में सबसे कठोर माना जाता हैं।
● हीरे का घनत्व बहुत ज्यादा है, इसका मान 3.51g cm-3 होता है।
● हीरा काँच को आसानी से काट देता है।
● पूर्ण आंतरिक परार्वतन के कारण ही यह अत्यधिक चमकता है।
● हीरा किसी द्रव में नहीं घुलता है तथा इस पर अम्ल एवं क्षार का भी प्रभाव नहीं पड़ता है।
● इसमें मुक्त इलेक्ट्रॉन नहीं होने के कारण यह विद्युत का संचालन नहीं कर सकता हैं। लेकिन हीरा ऊष्मा ऊर्जा का अच्छा संचालक है।
● हीरे की तापीय चालकता ताँबे से पाँच गुना ज्यादा होती है अत: इसे अपघर्षक के रूप में प्रयोग करने पर, घर्षण के द्वारा उत्पन्न हुई ऊर्जा को आसानी से नष्ट कर सकता है।
● हीरा शुद्ध रूप से X- किरणों के लिए पारदर्शी होता है अत: X- किरणें शुद्ध और संश्लेषित हीरे को भेदने में प्रयुक्त होती हैं।
उपयोग
● हीरा कठोर और अन्य सख्त पदार्थों को काटने एवं पीसने में प्रयोग किया जाता हैं।
● हीरा काँच काटने एवं चट्टानों में छेद करने वाले उपकरणों में प्रयुक्त किया जाता हैं।
● हीरा ज्वैलरी में काम में लिया जाता है। हीरे से सुंदर आभूषण बनाए जाते हैं। अपने उच्च अपवर्तक सूचकांक के कारण इसे अच्छे से काट कर पॉलिश करने पर यह अत्यधिक चमकदार बन जाता है।
2. ग्रेफाइट
● हीरे के समान ही ग्रेफाइट भी कार्बन का अत्यधिक उपयोगी क्रिस्टलीय अपरूप है।
● हीरे की तुलना में यह मुलायम, काला एवं फिसलन सहित ठोस है।
● ग्रेफाइट की चमक धातु जैसी है।
● ग्रेफाइट विद्युत और ऊष्मा का अच्छा संचालक है।
● कार्बन के तीन इलेक्ट्रॉन, कार्बन के तीन अन्य परमाणुओं के साथ सह-संयोजक आबंध द्वारा जुड़े हुए हैं।
● प्रत्येक कार्बन परमाणु का चौथा इलेक्ट्रॉन जो आबंध में भाग नहीं लेता है वह मुक्त अवस्था में विचरण करता है, जिस कारण यह विद्युत संचालन में सहायक है।
● कार्बन परमाणुओं की इन परतों के मध्य कमजोर संबंध होने के कारण ये परतें एक-दूसरे के ऊपर सरक सकती है। इसी प्रभाव के कारण ग्रेफाइट एक अच्छा ठोस स्नेहक बन पाता है।
● ग्रेफाइट का घनत्व हीरे की तुलना में कम अर्थात 2.2 gm cm-3 होता है।
● ग्रेफाइट का गलनांक (शून्य में) लगभग 3700°C है।
● अत्यधिक दाब एवं तापमान के प्रयोग द्वारा ग्रेफाइट को हीरे में परिवर्तित किया जा सकता है।
❒ ग्रेफाइट के उपयोग
● ग्रेफाइट शुष्क सेल एवं विद्युत आर्क्स में इलेक्ट्रोड बनाने में उपयोग किया जाता है।
● धातुओं को गलाने में प्रयुक्त होने वाले उच्च तापसह क्रुसिबल (Refractory Crucibles) के निर्माण में।
● ग्रेफाइट चूर्ण का उपयोग मशीनों में शुष्क स्नेहक के रूप में।
❒ हीरा एवं ग्रेफाइट में अंतर –
| हीरा | ग्रेफाइट |
| 1. यह कठोर होता है। | 1. जबकि यह मुलायम होता है। |
| 2. हीरा विद्युत का कुचालक होता है। | 2. ग्रेफाइट विद्युत का सुचालक होता है। |
| 3. इसका घनत्व 3.51 gm CM-3 होता है। | 3. ग्रेफाइट का घनत्व 2.2 gm CM-3 होता है। |
| 4. यह पारदर्शी एवं रंगहीन होता है। | 4. जबकि यह अपारदर्शी एवं राख के जैसा होता है। |
| 5. इसकी संरचना सम चतुष्फलकीय होती है। | 5. जबकि इसकी संरचना षट्कोणीय जालक सतह के रूप में होती है। |
3. फुलेरिन
● फुलेरिन को सर्वप्रथम 1985 रॉबर्ट एफ.कर्ल, हैरोल्ड डब्ल्यू क्रोटों और रिचर्ड ई. स्माइली द्वारा खोजा गया।
● फुलेरिन फुटबाल की तरह बंद संरचना है।
● बकमिन्सटर फुलेरिन नामक एक प्रारूपी फुलेरिन में 60 कार्बन परमाणु होते हैं।
● निष्क्रिय गैस के वातावरण में वाष्पित कार्बन संघनित होने पर फुलेरिन का निर्माण होता है।
उपयोग
● फुलेरिन का उपयोग सूक्ष्म बॉल-बेरिंग और हल्की बैटरी बनाने में किया जाता हैं।
● प्लास्टिक, दवाएँ तथा नए स्नेहक बनाने में भी इनका उपयोग किया जाता हैं।
3. सिलिकन –
प्रतीक चिह्न – Si
परमाणु क्रमांक-14
परमाणु भार – 28
अवस्थिति – समूह 14, आर्वत-3, ब्लॉक- p
इलेक्ट्रॉनिक विन्यास – 1s22s2, 2p2 , 3s2, 3p2
● यह प्रकृति में रेत और पत्थर के रूप में पाया जाता है।
● पृथ्वी पर ऑक्सीजन के बाद बाहुल्यता में पाया जाने वाला सिलिकन दूसरा तत्व है।
● यह पृथ्वी की परत में 27.69% प्रतिशत में पाया जाता है।
उपयोग –
● इस्पात या लोहे को अम्ल प्रतिरोधी बनाने में।
● काबेार्रेण्डम तथा मिश्रधातुओं के निर्माण में।
● अतिचालकता में।
● सिलिका वाटिका के निर्माण में।
● सिलिका जेल के रूप में इसका उपयोग शुष्ककारक के रूप में।
● कंप्यूटर चिप्स के निर्माण में।
● सिलिकोन नामक बहुलक के निर्माण में।
● अर्द्धचालक उपकरणों के निर्माण में।
❒ सिलिकॉन के यौगिक (Compounds of Silicon) –
i. सिलिका (Silica) – इसका रासायनिक सूत्र SiO2 है। SiO2 का क्रिस्टलीय रूप क्वार्ट्ज (Quartz) है। यह खनिज प्रकृति में सबसे अधिक मात्रा में पाया जाता है। इसका उपयोग सीमेंट के उत्पादन में तथा काँच निर्माण में होता है।
ii. क्रिस्टलीय क्वार्ट्ज (Crystalline Quartz) – दाब विद्युत पदार्थ तथा घड़ियाँ बनाने में इसका उपयोग किया जाता है।
iii. सिलिकन कार्बाइड (Silicon Carbide) – इसका रासायनिक सूत्र SiC है। इसे कार्बोरेण्डम (Carborendum) तथा कृत्रिम हीरा भी कहते हैं।
iv. सिलिकॉन्स (Silicones) – ये बहुलक का रूप है। इसका उपयोग जल सहवस्र, शल्य क्रिया प्रसाधन-संयंत्र, सीलित ग्रीस और विद्युत रोधी बनाने में होता है।
v. सिलेन्स (Silanes) – ये सिलिकॉन के हाइड्राइड हैं।
4. नाइट्रोजन –
प्रतीक चिह्न – N
परमाणु क्रमांक-7
परमाणु भार – 14
अवस्थिति – समूह 15, आर्वत-2, ब्लॉक-p
इलेक्ट्रॉनिक विन्यास – 1s2, 2s2, 2p3
● इसकी खोज 1772 में रदरफोर्ड ने की थी।
● वायुमण्डल में आयतन की दृष्टि से लगभग 78% भाग नाइट्रोजन का होता है।
● यह सोडियम नाइट्रेट (चिली साल्टपीटर या चीनी शोरा) तथा पोटैशियम नाइट्रेट (इण्डियन साल्टपीटर) के रूप में पाया जाता है।
● यह प्रोटीन में भी उपस्थित रहता है। यूरिया जैसे कार्बनिक यौगिक का प्रमुख अवयव है।
● पौधें मृदा से नाइट्रोजन नाइट्रेट के रूप में प्राप्त करते हैं। नाइट्रोजन 7N13, 7N14, 7N15 समस्थानिकों के रूप में पाया जाता है।
● नाइट्रोजन का अणु अध्रुवीय तथा द्विपरमाण्विक होता है।
❒ गुण –
● यह कमरे के ताप पर अक्रिय है।
● मैग्नीशियम के साथ क्रिया कर मैग्नीशियम नाइट्राइड का निर्माण करता है।
● यह रंगहीन, गंधहीन, स्वादहीन गैस हैं।
● यह अविषैली तथा अध्रुवीय गैस भी हैं।
उपयोग –
● इसका उपयोग विद्युत बल्बों तथा उच्च ताप मापने वाले तापमापी में करते हैं।
● अमोनिया के उत्पादन में।
● आयरन तथा स्टील उद्योगों में।
● द्रव नाइट्रोजन का उपयोग खाद्य सामग्री, जैविक पदार्थों तथा बैलों के वीर्य के परिरक्षण में तथा क्रायो सर्जरी में किया जाता है।
● सोडियम एलाइड का प्रयोग कार ड्राइवर की सुरक्षा के लिए एअर बैग में किया जाता है।
❒ नाइट्रोजन के यौगिक –
i. अमोनिया – प्रीस्टले ने सर्वप्रथम 1774 में अमोनियम क्लोराइड तथा लाइम के मिश्रण को गर्म किया जिससे अमोनिया गैस प्राप्त की तथा इस गैस को प्रीस्टले ने क्षारीय वायु कहा।
● 1785 में बर्थोलेट ने नाइट्रोजन तथा हाइड्रोजन के यौगिक को अमोनिया बताया। औद्योगिक पैमाने पर अमोनिया को हैबर विधि द्वारा उत्पादित किया जाता है जिसमें उत्प्ररेक के रूप में Fe का उपयोग किया जाता है।
❒ गुण –
● यह रंगहीन गैस है तथा इसकी गंध तीखी होती है।
● इसे सूंघनें पर छींक तथा आँखों में आँसू आ जाते हैं।
● यह चतुष्फलकीय अणु है तथा इसकी आकृति पिरामिडिय होती है।
● यह जल में अत्यन्त विलेय गैस है।
उपयोग –
● यूरिया के निर्माण में।
● हाइड्रोजन के उत्पादन में।
● सफाई के काम में चिकनाई दूर करने में।
● द्रव अमोनिया का उपयोग प्रशीतक के रूप में।
● प्रयोगशाला में प्रतिकारक के रूप में।
ii. नौसादर (Ammonium chloride) – इसका सामान्य सूत्र NH4Cl होता है तथा इसका व्यापारिक नाम अमोनियम क्लोराइड होता है।
उपयोग –
● प्रयोगशाला में प्रतिकारक के रूप में।
● बर्तनों में कलई करने में।
● शुष्क बैटरियों में।
● धातुओं को जोड़ने से पहले उन्हें साफ करने में।
● औषधि निर्माण में।
iii. नाइट्रिक अम्ल (Nitric Acid) – इसका सामान्य सूत्र HNO3 होता है। प्रयोगशाला में इसका उत्पादन वकयंत्र विधि, ओस्टवाल्ड विधि तथा बर्कलैंड आइड विधि द्वारा प्राप्त किया जाता है।
❒ गुण –
● यह रंगीन द्रव है।
● नाइट्रिक अम्ल एक भास्मिक अम्ल है।
● यह प्रबल ऑक्सीकारक भी है।
उपयोग –
● सोना तथा सिल्वर को शुद्ध करने में।
● प्रयोगशाला में प्रतिकारक के रूप में।
● डायमानाइट, ट्राइनाइट्रो टॉल्वीन (TNT), पिक्रिक अम्ल (TNP), ट्राइनाइट्रो बेन्जीन (TNB) आदि विस्फोटकों के निर्माण में।
● नाइट्रेट्स के उत्पादन में।
● कई धातुओं के लिए घोलक के रूप में।
● पीतल, कांसा, ताँबा आदि पर नाम लिखने या चित्र बनाने में।
iv. नाइट्रस ऑक्साइड (Nitrous oxide) –
● इसकी खोज का श्रेय प्रीस्टले को दिया जाता है। इसे ‘हँसी उत्पन्न करने वाली गैस’ या ‘Laughing gas’ कहते हैं क्योंकि इसे अल्प मात्रा में सूँघने पर हँसी उत्पन्न होती है।
● इसका सामान्य सूत्र N2O होता है।
● मिट्टी में उपस्थित चूना या क्षारीय पदार्थों से क्रिया कर नाइट्राइट एवं नाइट्रेट बनाते हैं।
उपयोग –
● शल्य क्रिया व दाँतों की सर्जरी में निश्चेतक के रूप में।
v. नाइट्रस अम्ल – इसका सामान्य सूत्र HNO2 होता है। यह अस्थायी अम्ल है। इसके लवणों को नाइट्राइट कहते हैं।
❒ गुण –
● यह ऑक्सीकारक तथा अवकारक दोनों गुण दर्शाता है।
उपयोग –
● फ्लैश फोटोग्राफी में प्रयुक्त होता है।
vi. अम्लराज – सान्द्र नाइट्रिक अम्ल का एक आयतन तथा सान्द्र हाइड्रोक्लोरिक अम्ल का तीन आयन के मिश्रण को अम्लराज कहते हैं। इसमें प्लेटियम, सोना आदि धातुएँ घुल जाते हैं।
❒ अन्य यौगिक –
● पोटैशियम नाइट्रेट (KNO3) को शोरा कहते हैं।
● कैल्सियम नाइट्रेट [Ca(NO3)2] को नार्वेजियन साल्टपीटर कहते हैं।
● सोडियम नाइट्रेट (NaNO3) को चिली साल्टपीटर कहते हैं।
● अमोनियम कार्बोनेट को स्मेल्टिंग साल्ट कहते हैं।
● क्लोरोस्टैनिक अम्ल के सान्द्र विलयन तथा अमोनियम क्लोराइड की क्रिया से प्राप्त लवण को पिंक साल्ट कहते हैं।
5. फॉस्फोरस –
प्रतीक चिह्न – p
परमाणु क्रमांक-15
परमाणु भार – 31
अवस्थिति – समूह 15, आर्वत-3, ब्लॉक-p
इलेक्ट्रॉनिक विन्यास – 1s2, 2s2, 2p6 3s2, 3p3
● फॉस्फोरस एक अभिक्रियाशील तत्व है।
● यह प्रकृति में मुक्त अवस्था में नहीं पाया जाता है। लगभग 58% कैल्सियम फॉस्फेट जानवरों की अस्थियों में पाया जाता है।
● यह प्राणियों के रक्त तथा शरीर में दूसरे भागों में भी पाया जाता है। दूध तथा अण्डों में फॉस्फोप्रोटीन्स उपस्थित होते हैं।
● फॉस्फोरस 15P31, 15P32 तथा 15P33 समस्थानिक रूपों में पाया जाता है।
उपयोग –
● फॉस्फोरस प्रकाश संश्लेषण की प्रक्रिया तथा पत्तियों के रंग के लिए आवश्यक है। इसकी कमी से पत्तियाँ अपना रंग खो देती है तथा सूख जाती है।
● अनाज के परिरक्षण में ऐलुमिनियम फॉस्फाइड का उपयोग किया जाता है।
● DNA तथा RNA के संश्लेषण में उपयोगी होता है।
● जिंक फॉस्फाइड का उपयोग चूहा-विष में किया जाता है।
❒ फॉस्फोरस के अपररूप
i. श्वेत/पीला फॉस्फोरस – इस अणु के चारों फॉस्फोरस परमाणु एक नियमित चतुष्फलक संरचना के कोणों पर जुड़े होते हैं।
● श्वेत फॉस्फोरस बहुत अधिक क्रियाशील होने के कारण जल में रखा जाता है क्योंकि कमरे के ताप पर यह आग पकड़ लेता है।
● इसे पीला फॉस्फोरस भी कहा जाता है, क्योंकि यह प्रकाश में रखने पर पीला पड़ जाता है।
● यह लहसुन जैसी गंध तथा विषैला पदार्थ है। यह जल में अविलेय तथा कार्बन डाइसल्फाइड (CS2) में विलेय होता है।
● श्वेत फॉस्फोरस वायु के संपर्क में आकर हल्के पीले रंग का प्रकाश देता है। इस गुण को स्फुरदीप्ति कहते हैं।
उपयोग –
● आतिशबाजी का सामान बनाने में।
● युद्धकाल में प्रयुक्त होने वाले धूम्र बम तथा अग्नि बम बनाने में।
● कास्टिक सोडा के घोल को श्वेत फॉस्फोरस के साथ गर्म करने पर फॉस्फीन प्राप्त होता है।
ii. लाल फॉस्फोरस – यह कार्बन डाइ ऑक्साइड तथा जल दोनों में अविलेय होता है। यह अविषैला तथा गंधहीन होता है।
● श्वेत फॉस्फोरस की तरह स्फूरदीप्ति प्रदर्शित नहीं करता है। यह अपारदर्शक तथा रवेदार ठोस पदार्थ होता है।
● इसका उपयोग निरापद दियासलाई (Safty Matches) बनाने में किया जाता है।
iii. काला फॉस्फोरस – इसके �-काला फॉस्फोरस तथा �-काला फॉस्फोरस दो रूप होते हैं।
● �- काला फॉस्फोरस वायु में ऑक्सीकृत नहीं होता है। -काला फॉस्फोरस विद्युत का सुचालक होता है तथा यह कार्बन डाई सल्फाइड में विलेय होता है। यह वायु में 673k ताप तक नहीं जलता है।
iv. सिन्दूरी फॉस्फोरस – इसे भी श्वेत फॉस्फोरस से प्राप्त किया जाता है।
● यह अविषैला पदार्थ तथा कार्बन डाइ सल्फाइड में विलय होता है। सिन्दूरी फॉस्फोरस लाल फॉस्फोरस की अपेक्षा अधिक क्रियाशील होता है।
v. बैंगनी फॉस्फोरस – इसकी खोज हिटॉर्फ ने की थी इसलिए इसे हिटॉर्फ फॉस्फोरस भी कहते हैं।
● यह विद्युत का कुचालक तथा अज्वलनशील होता है
❒ फॉस्फोरस के यौगिक
i. फॉस्फीन– पेड़ पौधों तथा अन्य कार्बनिक पदार्थों के सड़ने से दलदली स्थानों में फॉस्फीन गैस उत्पन्न होती है।
● यह रंगहीन तथा सड़ी मछली के समान गंध वाली गैस है। यह विषैली गैस भी है।
● उपयोग –
i. होम सिग्नल बनाने में कैल्सियम फॉस्फाइड का प्रयोग होता है। कैल्सियम फॉस्फाइड का उपयोग समुद्र में जहाजों को संकेत देने में करते हैं।
ii. धूम्र पट बनाने में भी कैल्सियम फॉस्फाइड का उपयोग करते हैं।
6. ऑक्सीजन –
प्रतीक चिह्न – O
परमाणु क्रमांक-8
परमाणु भार – 16
अवस्थिति – समूह 16, ब्लॉक- p
इलेक्ट्रॉनिक विन्यास – 1s2 2s2, 2p4
● इसकी खोज 1772 में शीले ने की। 1977 में ए.एल.लेवोइजर ने इसे ऑक्सीजन नाम दिया।
● ऑक्सीजन 8O16, 8O17 तथा 8O18 समस्थानिक रूपों में पाई जाती है।
● ऑक्सीजन स्वयं नहीं जलती परन्तु जलने में सहायक होती है। इसकी प्रकृति अनुचुम्बकीय होती है।
● यह रंगहीन, गंधहीन गैस हैं। यह वायु से कुछ भारी गैस है। ऑक्सीजन के अणु द्विपरमाण्विक होते हैं।
● इसे ठंडा करने पर यह नीले रंग के द्रव में बदल जाती है।
● इसे प्राण वायु कहा जाता है।
● ऑक्सीजन शुष्क वायु में आयतन के आधार पर लगभग 21% पाई जाती है। प्रकाश संश्लेषण, वायुमण्डलीय ऑक्सीजन का मुख्य स्रोत है।
● औद्योगिक रूप से वायु से प्रभाजी आसवन द्वारा ऑक्सीजन को प्राप्त किया जाता है।
उपयोग –
● श्वसन गैस है।
● अनेक धातुओं जैसे स्टील के उत्पादन में।
● ईंधन के दहन में सहायक है।
● रॉकेट ईंधन में ऑक्सीकारक के रूप में।
● कृत्रिम श्वसन में (हीलियम तथा ऑक्सीजन का मिश्रण)।
❒ ओजोन –
● यह ऑक्सीजन का एक अपररूप है।
● यह सूर्य के प्रकाश की उपस्थिति में वायुमण्लीय ऑक्सीजन से बनती है। यह एक त्रिपरमाणुक गैस है।
● इसकी गंध सड़ी मछली की तरह होती है। सूर्य से आने वाली हानिकारक पराबैंगनी किरणों को ओजोन गैस पृथ्वी पर आने से रोकती है।
● ओजोन गैस अवकारक तथा ऑक्सीकारक दोनों का गुण दर्शाती है। यह चाँदी की चमक को काला कर देती है। ओजोन एथिलिन से क्रिया कर ओजोनाइड बनाती है।
उपयोग –
● जल को साफ तथा शुद्ध करने में।
● कृत्रिम रेशम बनाने में।
● कीटाणुनाशक के रूप में।
● हवा को शुद्ध करने में।
● खाद्य पदार्थों को सड़ने से बचाने में।
● हाथी दाँत, स्टार्च आदि को विरंजित करने में।
7. सल्फर –
प्रतीक चिह्न – S
परमाणु क्रमांक-16
परमाणु भार – 32.06
अवस्थिति – समूह 16, आर्वत-3, ब्लॉक- p
इलेक्ट्रॉनिक विन्यास – 1s2, 2s22p6, 3s23p4
● सल्फर को ‘ताँबे का शत्रु’ तथा ‘ब्रिमस्टोन’ कहते हैं। सल्फर 16�32,16�33 ,16�34, 16�35तथा 16�36 समस्थानिक रूप में पाया जाता है।
● सल्फर प्रकृति में मुक्त तथा संयुक्त दोनों अवस्थाओं में मिलता है। सल्फर की प्रतिशतता भूपटल पर 0.05% है।
● सल्फर मुक्त अवस्था में ज्वालामुखी क्षेत्रों में तथा संयुक्त अवस्था में धातुओं के सल्फाइड तथा सल्फेट के रूप में पाई जाती है।
● अंडा, लहसुन, सरसों तेल, प्याज आदि पदार्थों में सल्फर पाया जाता है।
❒ सल्फर के अपररूप – सल्फर के क्रिस्टलीय तथा अक्रिस्टलीय अपररूप निम्नलिखित है
i. क्रिस्टलीय अपररूप –
❍ विषमलम्बाक्ष सल्फर या अष्टफलकीय सल्फर या सल्फर – यह का सर्वाधिक स्थाई रूप है।
● यह भंगुर तथा पीले रंग का है। यह जल में अविलेय तथा कार्बन डाइऑक्साइड में विलेय होता है।
● यह विद्युत का कुचालक है।
❍ एकनताक्ष सल्फर या सल्फर – यह 95.85°C के ऊपर ताप पर स्थाई तथा इसके नीचे ताप पर -सल्फर में परिवर्तित हो जाता है। 369 k या 95.85°C संक्रमण ताप कहलाता है क्योंकि इस ताप पर दोनों रूप स्थाई होते हैं।
ii. अक्रिस्टलीय सल्फर –
i. श्वेत सल्फर ii. प्लास्टिक सल्फर iii. दूधिया सल्फर
उपयोग –
● रबड़ को वल्कनीकृत करने में।
● कार्बन डाइ सल्फाइड, बारूद, दियासलाई, सल्फ्यूरिक अम्ल आदि के निर्माण में।
● दूधिया सल्फर का उपयोग औषधियों में।
● कीटाणुनाशी, कवकनाशी, जीवाणुनाशी, रंग तथा रंजक के उद्योग में।
● चर्म रोग में मलहम के रूप में।
● ब्यूटी पार्लर में बालों को सेट करने में।
● सल्फर के 8 अणु एक साथ जटिल रूप से जुड़े होने के कारण ही इसकी सरंचना ठोस होती है। साधारण सल्फर का रंग हल्का पीला होता है तथा यह भंगूर व रवेदार भी होता है।
● सल्फर कार्बन डाइ सल्फाइड (CS2) में विलेय तथा जल में अविलेय होता है। सल्फर विद्युत के साथ ऊष्मा का भी कुचालक होता है। सल्फर के उर्ध्वपातन के फलस्वरूप जो पाउडर या चूर्ण प्राप्त होता है, उस पाउडर को सल्फर का फूल कहते हैं।
● सल्फर की तीखी गंध सल्फ्यूरस यौगिक के उपस्थिति के कारण होती है।
❒ सल्फर के यौगिक
i. सल्फर डाइ ऑक्साइड – इसका सामान्य सूत्र SO2 होता है। यह ज्वालामुखी से निकलने वाली मुख्य गैसों में से एक है।
● इसकी गंध तीखी होती है तथा यह रंगहीन गैस है।
● इसके अणु की संरचना कोणीय (angular) होती है। यह गैस जल से भारी है तथा दम घोटने वाली विषैली गैस है।
● यह जल में अत्यधिक विलेय होती है तथा इसके जलीय घोल को सल्फ्यूरस अम्ल (H2SO3) कहते हैं।
उपयोग –
● इसका उपयोग प्रशीतक के रूप में होता है।
● रेशम तथा ऊन के लिए विरजंक के रूप में होता है, लेकिन इसकी विरजंन की क्रिया अस्थाई होती है।
● चीनी तथा पेट्रोलियम के शोधन में उपयेाग होता है।
● अनेक रसायनों के लिए विलायक के रूप में द्रव SO2 का उपयेाग होता है।
ii. सल्फर ट्राइ ऑक्साइड – इसका सामान्य सूत्र SO3 होता है। यह जल में विलेय होता है तथा इसके जलीय विलयन को सल्फ्यूरिक अम्ल (H2SO4) कहते हैं। इसलिए सल्फर ट्राइ ऑक्साइड को सल्फ्यूरिक अम्ल का ऐन्हाइड्राइड कहते हैं।
उपयोग
● ओलियम तथा सल्फ्यूरिक अम्ल बनाने में।
● अन्य गैसो के लिए निर्जलीकारक के रूप में।
iii. हाइड्रोजन सल्फाइड (H2S) – ज्वालामुखी से निकलने वाली अल्प मात्रा वाली गैसो में H2S उपस्थित रहती है।
● इसकी गंध सड़े अंडे की तरह होती है। यह विषैली तथा रंगहीन गैस है।
● हाइड्रोजन सल्फाइड (H2S) का विषहर (antidote) तनु क्लोरीन जल है।
iv. ओलियम – इसका सामान्य सूत्र H2S2O7 होता है। इसे पाइरोसल्फ्यूरिक अम्ल तथा सधूम सल्फ्यूरिक अम्ल भी कहते हैं।
● जब सल्फर डाइ ऑक्साइड (SO3) को सान्द्र सल्फ्यूरिक अम्ल में (H2SO4) घोला जाता है तो पाइरोसल्फ्यूरिक अम्ल (ओलियम) बनता है।
v. सल्फ्यूरस अम्ल (H2SO3) – सल्फ्यूरस अम्ल प्रबल द्विक्षारकी अम्ल है। यह ऑक्सीकारक तथा अवकारक दोनों गुण दर्शाता है। इसका विरजंक गुण अवकारक गुण के कारण (SO2 के समान) होता है।
vi. सल्फ्यूरिक अम्ल (H2SO4) – इसे रसायनों का सम्राट (chemical king) तथा कसीस का तेल (oil of vitriol) कहते हैं।
● सल्फ्यूरिक अम्ल को औद्योगिक पैमाने पर संपर्क विधि तथा लेड-कक्ष विधि द्वारा बनाया जाता है।
● सल्फ्यूरिक अम्ल रंगहीन होता है तथा यह गाढ़ा तैलीय द्रव है। यह जल में अत्यधिक विलेय होता है।
● यह एक प्रबल निर्जलीकारक है।
उपयोग –
● इसका उपयोग महत्वपूर्ण रसायनों (ईथर, धातु, फिटकरी, सल्फेटों आदि) के निर्माण में करते हैं।
● इसका उपयोग स्टोरेज बैटरी, पेट्रोलियम के शुद्धीकरण मे, खनिजों के निष्कर्षण में तथा अवशिष्ट जल के उपचार में होता है।
● इसका उपयोग अपमार्जकों, उर्वरकों तथा औषधियों में होता है।
● इसका उपयोग विस्फोटकों (TNT (नाइट्रोग्लिसरीन), गन कॉटन, पिक्रिक अम्ल) के निर्माण में होता है।
● इसका उपयोग शुष्ककारक तथा ऑक्सीकारक के रूप में होता है।
8. हैलोजन – फ्लोरीन (F), क्लोरीन (Cl), ब्रोमीन (Br), आयोडीन (I) तथा एस्टेटीन (At) को संयुक्त रूप से हैलोजन कहते हैं।
● इन सभी तत्वों को आवर्त सारणी के वर्ग 17 में रखा है। यह तत्व धातुओं के साथ क्रिया करके लवण बनाते हैं। इसलिए इन तत्वों को हैलोजन कहते हैं।
● हैलोजन तत्व अधिक क्रियाशील होने के कारण मुक्त अवस्था में नहीं पाए जाते हैं। इन तत्वों के बाह्यतम कोश का इलेक्ट्रॉनिक विन्यास ns2np5 होता हैं।
● ये तत्व दृश्य-प्रकाश को अवशोषित करते हैं। इसलिए ये तत्व रंगीन होते हैं।
● हैलोजन के तत्वों में आयोडीन ठोस अवस्था मे, ब्रोमीन द्रव अवस्था में, फ्लोरीन व क्लोरीन गैसीय अवस्था में पाए जाते हैं तथा एस्टेटीन रेडियाधर्मी तत्व है।
i. फ्लोरीन–
प्रतीक चिह्न – F
परमाणु क्रमांक-9
परमाणु भार – 19
इलेक्ट्रॉनिक विन्यास – 1s2,2s22p5
● फ्लोरीन आर्वत सारणी का सबसे अधिक विद्युत ऋणी तत्व है इसलिए यह सर्वाधिक क्रियाशील होता है।
● इस गैस का रंग पीला होता है।
उपयोग
● UF6 तथा SF6 बनाने में (UF6 का उपयोग परमाणु ऊर्जा उत्पादन में तथा SF6 का उपयोग परावैद्युगिकी में होता है)।
● स्टील निर्माण, वेल्डिंग रॉड में, एल्यूमिनियम के शोधन में।
● रेफ्रिजरेटर तथा एअर कन्डीशन में।
● जीवाणु नाशक, फास्फोरस युक्त रासायनिक उर्वरक में।
ii. क्लोरिन –
प्रतीक चिह्न – Cl
परमाणु क्रमांक-17
परमाणु भार – 34.45
इलेक्ट्रॉनिक विन्यास – 1s2, 2s2 ,2p6, 3s2, 3p5
● इसकी खोज 1774 में शीले ने की। औद्योगिक स्तर पर इसका निर्मान डीकन विधि, नेल्सन विधि, वेल्डन विधि आदि द्वारा किया जाता है।
● यह तीखी गंध वाली गैस तथा हरित पीली गैस है। क्लोरीन गैस वायु से भारी तथा जल में विलेय होती है।
● यह नाक, गले तथा फेफड़ों पर अधिक प्रभाव डालती है तथा यह विषैली गैस भी है।
● यह चूने के साथ क्रिया करके ब्लीचिंग पाउडर (CaoCl2) बनाती है।
उपयोग
● विरजंक के रूप में।
● विषैली गैस (ल्यूसाइट, फॉस्जीन, मस्टर्ड गैस आदि) के उत्पादन में।
● रोगाणुनाशक के रूप में।
● प्लेटिनम तथा सोने के निष्कर्षण में।
● औषधि तथा कार्बनिक पदार्थ, प्रशीतक आदि के उत्पादन में।
iii. ब्रोमीन –
प्रतीक चिह्न – Br
परमाणु क्रमांक-35
परमाणु भार – 79.9
इलेक्ट्रॉनिक विन्यास – [Ar] 3d11, 4s2, 4p5
● इसकी मात्रा समुद्री जल में लगभग 0.068% होती है तथा भारत के कच्छ के रन में ब्रोमीन ब्राइन के रूप में मिलती है।
● साधारण ताप पर इसका रंग गहरा लाल बादामी जैसा होता है।
उपयोग
● फोटोग्राफी में सिल्वर ब्रोमाइड के रूप में।
● प्रतिकारक के रूप में।
● नींद की दवा (पौटेशियम ब्रोमाइड) बनाने में।
● आँसू गैस तथा अन्य विषैली गैस बनाने में।
● ब्रोमेट, ब्रोमाइड, हाइपोब्रोमाइड बनाने में।
iv. आयोडीन –
प्रतीक चिह्न – I
परमाणु क्रमांक-53
परमाणु भार – 126.9
इलेक्ट्रॉनिक विन्यास – [Kr] 4d11, 5s2, 5p5
● यह प्रबल ऑक्सीकारक है। समुद्री जल तथा समुद्री खरपतवार में संयुक्त अवस्था आयोडाइड के रूप में पाई जाती है।
● आयोडीन मानव शरीर मे थाइरॉइड ग्रंथि में थाइरॉक्सिन के रूप में पाई जाती है। आयोडीन की कमी से मानव शरीर में घेंघा या गलगण्ड (Goitre) बीमारी हो जाती है।
● आयोडीन गहरे बैंगनी रंग का होती है।
उपयोग
● जीवाणुनाशी के रूप में।
● औषधियों (पीड़ाहारी व पूतिरोधी) के रूप में।
● फोटोग्राफी फिल्मों में।
● प्रयोगशाला अभिकर्म के रूप में।
● टिचंर – आयोडीन, आयोडेक्स आदि के निर्माण में।
v. एस्टेटीन (At) – यह एक रेडियाधर्मी तत्व है। भूपटल में सबसे कम मात्रा में पाए जाने वाला तत्व तथा ठोस अधातुओं में सबसे भारी है।
❖ अक्रिय गैस
● हीलियम (He), निऑन (Ne), ऑर्गन (Ar), क्रिप्टॉन (Kr), जेनॉन (Xe) तथा रेडॉन (Rn) को संयुक्त रूप से अक्रिय गैसें कहते हैं क्योंकि ये सभी गैसें रासायनिक रूप से अक्रिय होती हैं।
● इन गैसों के कुछ सदस्य जैसे Xe, ऑक्सीजन तथा फ्लोरीन के साथ क्रिया भी करते है इसलिए इनको उत्कृष्ट गैसें भी कहते हैं।
● इन सभी गैसों को आवर्त सारणी के शून्य वर्ग या वर्ग 18 में रखा गया हैं। रेडॉन के अतिरिक्त सभी उत्कृष्ट गैसें वायुमंडल में पाई जाती है।
● दुर्लभ रूप से प्राप्त होने के कारण इन गैसों को दुर्लभ गैस भी कहते हैं।
i. हीलियम (He) – इसकी खोज लोकेयर ने की। इसकी परमाणु क्रमांक 2 तथा द्रव्यमान क्रमांक 4 है। यह अज्वलनशील तथा हल्की गैस है। इसका मुख्य स्रोत प्राकृतिक गैस है।
उपयोग
● वायुयान के टायरों में भरने में।
● निम्न तापीय अभिकर्म के रूप में।
● अस्पतालों में कृत्रिम साँस (हीलियम तथा ऑक्सीजन का मिश्रण) के रूप में।
● गोताखोरों के उपकरणों में।
● बैलून में हवा भरने में।
ii. निऑन (Ne) – इसकी खोज रैमजे तथा टैवर्ज ने की। इसका परमाणु क्रमांक 10 तथा द्रव्यमान क्रमांक 20 है।
उपयोग
● नियॉन लैम्प बनाने में जिसका प्रयोग हवाई अड्डों पर विमान चालकों को संकेत देने में करते है।
● स्फुरदीप्ति बल्बों में।
● चमकने वाले विज्ञापनों में।
● निऑन बल्ब का उपयोग ग्रीन हाउस तथा वनस्पति उद्यान में करते हैं।
iii. आर्गन (Ar) – इसकी खोज रैमजे तथा रैले ने की। इसकी परमाणु क्रमांक 18 तथा द्रव्यमान क्रमांक 40 है। यह वायुमंडल में सर्वाधिक मात्रा में पाया जाता है।
उपयोग
● विद्युत बल्बों में भरने में।
● धातुओं या मिश्रधातुओं की आर्क वेल्डिंग में निष्क्रीय वातावरण उत्पन्न करने में।
iv. क्रिप्टॉन (Kr) – इसकी खोज ट्रेवर्स तथा रैमजे ने की। इनका परमाणु क्रमांक 36 तथा द्रव्यमान क्रमांक 84 है।
उपयोग
● एप्रोच लाइट तथा एअरपोर्ट रनवे में।
v. जेनॉन (Xe) – इसकी खोज टैवर्स तथा रैमजे ने की। इसकी परमाणु क्रमांक 54 तथा द्रव्यमान क्रमांक 131 है। यह अक्रिय गैस सर्वाधिक यौगिक बनाती है।
उपयोग
● उच्च तीव्रता वाले फोटोग्राफिक फ्लैश ट्यूब में।
vi. रेडॉन (Rn) – इसकी खोज डोर्न ने की। यह रेडियोसक्रिय तत्व है।
उपयोग
● कैंसर के उपचार में।
❒ उपधातु – वे तत्व जो धातु तथा अधातु दोनों के गुणों को दर्शाते है, उपधातु कहलाते हैं। आर्वत सारणी में इन तत्वों को धातु तथा अधातु के मध्य रखा है। इनकी क्रमांक 7 है, जो निम्नलिखित है –
● i बोरोन (B) ii सिलिकन (Si)
iii जर्मेनियम (Ge) iv आर्सेनिक (As)
v एन्टिमनी (Sb) vi टेलेरियम (Te)
vii पोलोनियम (Po)
i. बोरोन (B) – इसका उपयोग बोरिक अम्ल (H3BO3), अकार्बनिक ग्रेफाइट, अकार्बनिक बेंजीन बनाने में होता है। बोरिक अम्ल का उपयोग एन्टीसेप्टिक दवा बनाने में होता है। इसका उपयोग काँच उद्योग तथा खाद्य परिरक्षण में भी होता है।
ii. एन्टिमनी (Sb) – एन्टिमनी सल्फाइड (Sb2S3) का उपयोग दियासलाई में होता है।
iii. जर्मेनियम (Ge) – इसका उपयोग ट्रांजिस्टर बनाने में, फोटो इलेक्ट्रिल सेल में, सोलर सेल में होता है।
iv. पोलोनियम (PO) – यह प्रथम मानव निर्मित तत्व है। इसके सबसे अधिक क्रमांक में समस्थानिक पाए जाते हैं।
v. आर्सेनिक (As) – गैलियम आर्सेनाइड अर्द्धचालक के रूप में ट्रांजिस्टरों में, सोलर सेल, फोटोडायोड में होता है। गैलियम आर्सेनाइड का उपयोग कंप्यूटर चिप्स बनाने में भी होता है
अन्य अध्ययन सामग्री
ऊष्मा किसे कहते हैं? गुप्त ऊष्मा, परिभाषा, प्रकार, सूत्र, मात्रक Heat in Hindi
चुम्बक किसे कहते है? प्रकार, गुण, चुंबकीय तरंग, क्षेत्र
ध्वनि किसे कहते हैं? परिभाषा, गुण, लक्षण, प्रकार ( Dhwani kya hai )
अम्ल किसे कहते हैं? परिभाषा, प्रकार, उपयोग, उदाहरण What is Acid in Hindi
महत्वपूर्ण प्रश्न
धातु क्या है उदाहरण दीजिए?
तत्व जो इलेक्ट्रॉन त्यागकर धनायन बनाने की प्रवृत्ति रखते हैं, धातु कहलाते हैं।
धातुएँ आर्वत सारणी में बायीं ओर एवं मध्य में स्थित हैं।
सोना, चांदी, कॉपर,लोहा
धातु कितने प्रकार के होते हैं?
1-मौलिक धातु 2-यौगिक धातु