नमस्कार आज हम सामान्य विज्ञान के महत्वपूर्ण अध्याय में से एक कार्बन तथा उसके यौगिक (Carbon & Their Compounds) के बारे में पढ़ेंगे। इस अध्ययन के दौरान हम इस टॉपिक से जुड़े विभिन्न महत्वपूर्ण बिन्दुओ पर विस्तार पूर्वक चर्चा करेंगे जैसे कार्बन की खोज, कार्बन के अपररूप, कार्बन के ऑक्साइड इत्यादि। यहां आपके सारे सवालो का जवाब देने का प्रयास किया गया है। परीक्षा की दृष्टि से बहुत से ऐसे महत्वपूर्ण प्रश्नो का समावेश है जो आपके तैयारी को और अधिक संबल प्रदान करेंगे।
परीक्षा की दिर्ष्टि से देखे तो यह बहुत ही महत्वपूर्ण टॉपिक है क्योंकि आपने यदि किसी भी एग्जाम का पेपर देखा हो तो आप जरुरु देखेंगे की किस प्रकार से आजकल बहुत से प्रश्न इस अध्याय में से लिए जाते है। यदि आप इस अध्याय मात्र को अच्छे से तैयार कर लेते है तो आप आसानी से बहुत अच्छे अंक प्राप्त कर सकते हैं। तो आइये शुरू करते है कार्बन तथा उसके यौगिक (Carbon & Their Compounds) का अध्ययन।
कार्बन तथा उसके यौगिक
| कार्बन प्रतीक | C |
| परमाणु क्रमांक | 6 |
| परमाणु द्रव्यमान | 12 |
| इलेक्ट्रॉनिक विन्यास | 1s2, 2s2, 2p2 |
| संयोजकता | +4, तथा –4 |
| समस्थानिक | C12, C13, C14 |
• नोट– C14 रेडियोएक्टिव होता है। इसकी अर्द्ध आयु 5730 वर्ष होती है। इसका उपयोग प्राचीन जीवाष्म की आयु पता करने के लिए रेडियो कॉर्बन काल निर्धारण विधि में होता हैं।
• कार्बन P- ब्लॉक का तत्व है। कार्बन आर्वत सारणी के उपवर्ग IV A का प्रथम सदस्य है। इस कारण इस उपवर्ग के तत्वों को कार्बन वर्ग के तत्व कहते हैं
• इस उपवर्ग में कार्बन के अतिरिक्त सिलिकन, जर्मेनियम, टिन तथा लेड हैं।
• इस उपवर्ग में लेड को छोड़कर सभी सदस्य अपरूपता (Alotropy) का गुण प्रदर्शित करते हैं।
• कार्बन एवं सिलिकॉन अधातुएँ हैं।
• जर्मेनियम उपधातु है।
• टिन और लेड धातु है।
• कार्बन अन्य तत्वों जैसे– हाइड्रोजन (H), नाइट्रोजन (N), ऑक्सीजन (O), सल्फर (S), एवं हैलोजन के परमाणु के साथ आबंध बना सकता है।
• कार्बन के कई परमाणु परस्पर सहयोग से सह-संयोजक बंध बना सकते हैं।
• कार्बन परमाणुओं की एक लंबी श्रृंखला बना सकता हैं, लंबी श्रृंखला बनाने की यह प्रक्रिया श्रृंखलन के रूप में जानी जाती है।
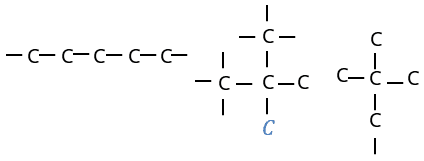
• कार्बन के सबसे बाहरी कोश मे चार इलेक्ट्रॉन होते हैं तथा उत्कृष्ट गैस विन्यास को प्राप्त करने के लिए इसको चार इलेक्ट्रॉन प्राप्त करने या खोने की आवश्यकता होती है।
❍ यदि इन्हें इलेक्ट्रॉनों को प्राप्त करना या खोना हो तो –
• ये चार इलेक्ट्रॉन प्राप्त कर C4- ऋणायन बना सकता हैं, लेकिन छ: प्रोटॉन वाले नाभिक के लिए दस इलेक्ट्रॉन अर्थात चार अतिरिक्त इलेक्ट्रॉन धारण करना मुश्किल हो सकता है।
• ये चार इलेक्ट्रॉन खोकर C4+ धनायन बना सकता है, लेकिन चार इलेक्ट्रॉनों को खो कर छ: प्रोटॉन वाले नाभिक में केवल दो इलेक्ट्रॉनों का कार्बन धनायन बनाने के लिए अत्यधिक ऊर्जा की आवश्यकता होगी।
• कार्बन प्रकृति में मुक्त और संयुक्त दोनों ही अवस्थाओं में पाया जाता हैं।
• हीरा, ग्रेफाइट तथा कोयले के रूप में यह प्रकृति में मुक्त अवस्था में पाया जाता है।
• जबकि कार्बन धातु के कार्बोनेट, बाइकार्बोनेटस, CO2, प्रोटीन तथा अन्य जटिल यौगिकों के रूप में संयुक्त अवस्था में पाया जाता हैं।
• कार्बन एक सार्वभौमिक तत्व के रूप में जाना जाता है।
• कार्बन के विभिन्न रूपों को जिनके रासायनिक गुण समान, लेकिन भौतिक गुणों में अंतर पाया जाता हैं, कार्बन के अपरूप कहलाते हैं।
कार्बन के अपरूप –
कार्बन मुक्त अवस्था में तीन अपरूपों में पाया जाता हैं –
(i) हीरा (ii) ग्रेफाइट (iii) फुलेरीन
1. हीरा (Diamond) –
• हीरा कार्बन का क्रिस्टलीय अपरूप है।
• हीरा पृथ्वी के आंतरिक भाग में उच्च तापमान (लगभग 1500°C) और उच्च दाब (लगभग 70,000 वायुमंडल) की परिस्थितियों में विकसित होता है।
• यह प्रकृति में किम्बरलाइट पत्थर के रूप में पाया जाता है।
• विश्व में ‘दक्षिण अफ्रीका’ हीरे का सबसे अधिक उत्पादक देश है।
• भारत में हीरा पन्ना मध्य प्रदेश एवं वज्रकरुर आंध्र प्रदेश में पाया जाता है।
• हीरे की शुद्धता का मापन ‘कैरेट’ में किया जाता है।
1 कैरेट = 200 Mg
• शुद्ध हीरा पारदर्शक एवं रंगहीन होता है, लेकिन इसमें पाई जाने वाली अशुद्धियों के कारण यह कई रंगों में पाया जाता हैं।
• कुछ हीरे काले रंग में पाए जाते हैं जिन्हें बोर्ट कहा जाता हैं।
• एक हीरे के क्रिस्टल में प्रत्येक कार्बन परमाणु चार अन्य कार्बन परमाणुओं से चतुष्फलकीय व्यवस्था में सह-संयोजक आबंध द्वारा जुड़कर दृढ़ त्रिविमीय जालक का निर्माण करते हैं।
• सह-संयोजक आबंधता के जाल द्वारा बनाई गई कार्बन परमाणु की त्रि-आयामी व्यवस्था हीरे को एक कठोर संरचना प्रदान करती है।
• यह दृढ़ता हीरे को अत्यधिक कठोर बनाती हैं। इस कारण हीरा पृथ्वी पर प्राकृतिक पदार्थों में सबसे कठोर माना जाता हैं।
• हीरे के अतिरिक्त अन्य कठोर पदार्थ सिलिकॉन कार्बाईड हैं जिसे कार्बोरेडम भी कहते हैं।
• लेकिन हीरा प्राकृतिक रूप से पाया जाता है, जबकि कार्बोरेडम कृत्रिम पदार्थ है।
• हीरे का घनत्व बहुत ज्यादा है, इसका मान 3.51g cm-3 होता है।
• हीरा काँच को आसानी से काट देता है।
• पूर्ण आंतरिक परार्वतन के कारण ही यह अत्यधिक चमकता है।
• हीरा किसी द्रव में नहीं घुलता है तथा इस पर अम्ल एवं क्षार का भी प्रभाव नहीं पड़ता है।
• हीरे का गलनांक (शून्य में) भी बहुत ही उच्च लगभग 3500°C है क्योंकि सह-संयोजक आबंध के त्रि-आयामी जाल को तोड़ने के लिए अत्यधिक ऊष्मा ऊर्जा की आवश्यकता होती है।
• इसमें मुक्त इलेक्ट्रॉन नहीं होने के कारण यह विद्युत का संचालन नहीं कर सकता हैं। लेकिन हीरा ऊष्मा ऊर्जा का अच्छा संचालक है।
• हीरे की तापीय चालकता ताँबे से पाँच गुना ज्यादा होती है अत: इसे अपघर्षक के रूप में प्रयोग करने पर, घर्षण के द्वारा उत्पन्न हुई ऊर्जा को आसानी से नष्ट कर सकता है।
• हीरा शुद्ध रूप से X- किरणों के लिए पारदर्शी होता है अत: X- किरणें शुद्ध और संश्लेषित हीरे को भेदने में प्रयुक्त होती हैं।
• हीरा पोटैशियम डाइक्रोमेट (K2Cr2O7) एवं सान्द्र H2SO4 के साथ 200°C पर गर्म करने पर CO2 गैस उत्पन्न करता है।
उपयोग
• हीरा कठोर और अन्य सख्त पदार्थों को काटने एवं पीसने में प्रयोग किया जाता हैं।
• हीरा काँच काटने एवं चट्टानों में छेद करने वाले उपकरणों में प्रयुक्त किया जाता हैं।
• हीरा ज्वैलरी में काम में लिया जाता है। हीरे से सुंदर आभूषण बनाए जाते हैं। अपने उच्च अपवर्तक सूचकांक के कारण इसे अच्छे से काट कर पॉलिश करने पर यह अत्यधिक चमकदार बन जाता है।
नोट-
• कृत्रिम हीरा सर्वप्रथम मोयासां द्वारा 1893 में बनाया गया।
• काला हीरा कार्बोनेडों भी कहलाता हैं।
• हीरे की संरचना नियमित चतुष्फलकीय होती है।
2. ग्रेफाइट
• हीरे के समान ही ग्रेफाइट भी कार्बन का अत्यधिक उपयोगी क्रिस्टलीय अपरूप है।
• हीरे की तुलना में यह मुलायम, काला एवं फिसलन सहित ठोस है।
• ग्रेफाइट की चमक धातु जैसी है।
• ग्रेफाइट विद्युत और ऊष्मा का अच्छा संचालक है।
• भारत में ग्रेफाइट ओडिशा राज्य में प्रचुर मात्रा में पाया जाता है।
• ग्रेफाइट में कार्बन परमाणु की परतें होती हैं, प्रत्येक परत में कार्बन का एक विशेष परमाणु 120° के एक मोड़ कोण के साथ अन्य तीन परमाणुओं के साथ त्रिकोणीय प्लानर व्यवस्था में जुडा हुआ है।
• इस प्रक्रिया में कार्बन के तीन इलेक्ट्रॉन, कार्बन के तीन अन्य परमाणुओं के साथ सह-संयोजक आबंध द्वारा जुड़े हुए हैं।
• प्रत्येक कार्बन परमाणु का चौथा इलेक्ट्रॉन जो आबंध में भाग नहीं लेता है वह मुक्त अवस्था में विचरण करता है, जिस कारण यह विद्युत संचालन में सहायक है।
• कार्बन परमाणुओं की इन परतों के मध्य कमजोर संबंध होने के कारण ये परतें एक-दूसरे के ऊपर सरक सकती है। इसी प्रभाव के कारण ग्रेफाइट एक अच्छा ठोस स्नेहक बन पाता है।
• ग्रेफाइट का घनत्व हीरे की तुलना में कम अर्थात 2.2 gm cm-3 होता है।
• ग्रेफाइट का गलनांक (शून्य में) लगभग 3700°C है।
• अत्यधिक दाब एवं तापमान के प्रयोग द्वारा ग्रेफाइट को हीरे में परिवर्तित किया जा सकता है।
❍ ग्रेफाइट के उपयोग
• ग्रेफाइट शुष्क सेल एवं विद्युत आर्क्स में इलेक्ट्रोड बनाने में उपयोग किया जाता है।
• धातुओं को गलाने में प्रयुक्त होने वाले उच्च तापसह क्रुसिबल (Refractory Crucibles) के निर्माण में।
• ग्रेफाइट चूर्ण का उपयोग मशीनों में शुष्क स्नेहक के रूप में।
• ग्रेफाइट अपनी कोमल प्रकृति और स्तरित संरचना के कारण कागज पर काला निशान छोड़ देता है। इस कारण यह पेंसिल के रूप में लिखने के लिए प्रयुक्त किया जाता है।
नोट-
• कृत्रिम ग्रेफाइट ‘एचीसन’ विधि से बनाया जाता है।
• ग्रेफाइट हवा एवं ऑक्सीजन की उपस्थिति में उच्च ताप पर गर्म करने पर CO2 देता है।
• ग्रेफाइट अम्ल, क्षार के प्रति अक्रिय होता है, लेकिन सान्द्र H2SO4, पोटैशियम डाइक्रोमेट (K2Cr2O7) के साथ गर्म करने पर यह ऑक्सीकृत होकर CO2 में परावर्तित हो जाता है।
❍ हीरा एवं ग्रेफाइट में अंतर –
| हीरा | ग्रेफाइट |
| 1. यह कठोर होता है। | 1. यह मुलायम होता है। |
| 2. हीरा विद्युत का कुचालक होता है। | 2. ग्रेफाइट विद्युत का सुचालक होता है। |
| 3. इसका घनत्व 3.51 gm cm-3 होता है। | 3. ग्रेफाइट का घनत्व 2.2 gm cm-3 होता है। |
| 4. यह पारदर्शी एवं रंगहीन होता है। | 4. यह अपारदर्शी एवं राख के जैसा होता है। |
| 5. इसकी संरचना समचतुष्फलकीय होती है। | 5. इसकी संरचना षट्कोणीय जालक सतह के रूप में होती है। |
3. फुलेरिन
• फुलेरिन को सर्वप्रथम 1985 रॉबर्ट एफ.कर्ल, हैरोल्ड डब्ल्यू क्रोटों और रिचर्ड ई. स्माइली द्वारा खोजा गया।
• इन सभी को फुलेरिन की खोज के लिए रसायन विज्ञान में नोबेल पुरस्कार प्रदान किया गया।
• फुलेरिन फुटबाल की तरह बंद संरचना है।
• बकमिन्सटर फुलेरिन नामक एक प्रारूपी फुलेरिन में 60 कार्बन परमाणु होते हैं।
• निष्क्रिय गैस के वातावरण में वाष्पित कार्बन संघनित होने पर फुलेरिन का निर्माण होता है।
❍ उपयोग
• फुलेरिन का उपयोग सूक्ष्म बॉल, बेरिंग और हल्की बैटरी बनाने में किया जाता हैं।
• प्लास्टिक, दवाएँ तथा नए स्नेहक बनाने में भी इनका उपयोग किया जाता हैं।
इन तीन अपररूपों के अतिरिक्त कार्बन 3 सूक्ष्म क्रिस्टलाइन और ग्रेफाइट के निराकर रूप में भी पाया जाता हैं जो लकड़ी का कोयला, कोक और कार्बन ब्लैक हैं।
1. कोयला
• कोयला मुख्यत: कार्बन के यौगिकों का मुक्त कार्बन का मिश्रण है।
• यह ऊर्जा का अनवीकरणीय स्रोत है।
• कोयला वानस्पतिक पदार्थों के कार्बनीकरण (Carbonisation) की प्रक्रिया द्वारा प्राप्त किया जाता हैं।
❍ कार्बन की प्रतिशत मात्रा के आधार पर कोयले को चार वर्गों में बाँटा गया हैं –
• P < L< B < A
| कोयले का प्रकार | पीट (P) | लिग्नाइट (L) | बिटुमिनस (B) | एन्थ्रेसाइट (A) |
| कार्बन की मात्रा | 27% | 28 – 70% | 78 – 86% | 94 – 98% |
| अत्यधिक धुआँ उत्पन्न करता है, निम्न कोटि का कोयला। | राजस्थान में सर्वाधिक, भूरा कोयला भी कहा जाता हैं, जल वाष्प की मात्रा अधिक। | मुलायम कोयला कहा जाता है, भारत में सर्वाधिक घरेलु कार्यों में उपयोग। | नीली लौह से कम धुआँ, कम राख, उच्च कोटि का कोयला। |
• विश्व में 90% कोयला उत्तरी गोलार्द्ध में पाया जाता है।
2. चारकोल
• चारकोल रंध्रीय रचना और अधिक पृष्ठ क्षेत्रफल के कारण कार्बन का अशुद्ध रूप है।
• लकड़ी को वायु की अनुपस्थिति में गर्म करने पर चारकोल प्राप्त होता है।
• इनमें गैसों को अवशोषित करने की उच्च क्षमता पाई जाती हैं।
❍ चारकोल निम्न प्रकार के होते हैं –
i. काष्ठ चारकोल (Wood Charcoal) –
• यह एक अच्छा अपचायक है तथा कीटाणुनाशक गुणों को प्रदर्शित करता हैं।
• काष्ट चारकोल का उपयोग विस्फोटक बनाने, गैसों को अवशोषित करने, जलाने, चारकोल अत्यधिक सरंध्रीय होने के कारण गैस मास्क में भी प्रयुक्त किया जाता हैं।
ii. अस्थि चारकोल –
• इसे हड्डियों के भंजन आसवन द्वारा प्राप्त किया जाता हैं।
• कार्बनिक पदार्थों का विरंजन अस्थि चारकोल द्वारा ही प्राप्त किया जाता है।
• इनके अतिरिक्त शर्करा चारकोल और रक्त चारकोल भी पाए जाते हैं।
iii. कोक –
• खनिज कोयला (बिटुमिनस) को उच्च ताप पर गर्म कर भंजक-आसवन विधि से कोक का निर्माण होता हैं।
• कोयले को वायु की अनुपस्थिति में गर्म करने पर वाष्पशील अशुद्धियाँ दूर हो जाती है। बचा हुआ कार्बन कोक कहलाता हैं।
• कोक, कठोर, सरंध्र एवं काला पदार्थ है।
• कोक का उपयोग इस्पात के औद्योगिक निर्माण और बहुत से धातुओं के निष्कर्षण में किया जाता हैं।
कार्बन के यौगिक –
• कार्बन के यौगिकों को दो वर्गों को बाँटा जा सकता है –
(i) कार्बनिक यौगिक
(ii) अकार्बनिक यौगिक
• कार्बनिक यौगिक प्राकृतिक स्रोतों जैसे- पौधे, जानवर, कोयला एवं पेट्रोलियम पदार्थ से प्राप्त किए जाते हैं।
• कोयले से हमें बेंजीन, फीनोल तथा नेफ्थेलीन आदि प्राप्त होते हैं।
• जबकि पेट्रोलियम से पेट्रोल, कोयला, केरोसीन, चिकनाई युक्त तेल, मोम एवं अन्य यौगिकों को प्राप्त किया जाता हैं।
• कार्बनिक पदार्थों की संख्या अकार्बनिक पदार्थों की तुलना में अधिक ज्यादा हैं।
• कार्बन के यौगिक जो कार्बनिक यौगिक नहीं है, उन्हें अकार्बनिक यौगिक कहते हैं।
• अधिकांश अकार्बनिक यौगिक अनेक खनिजों से प्राप्त होते हैं।
उदाहरण – चूना पत्थर, संगमरमर और डोलोमाइट में कार्बन कार्बोनेट के रूप में उपस्थित हैं।
• इसके अतिरिक्त अकार्बनिक यौगिक धातुओं के कार्बाइड जैसे – कैल्शियम कार्बाइड (CaC2), HCN, CS2 तथा कार्बन के ऑक्साइड जैसे – CO2, CO हैं।
• कार्बनिक एवं अकार्बनिक यौगिकों के गुण प्राय: एक-दूसरे से भिन्न होते हैं।
• कार्बनिक यौगिक सामान्यत: कम गलनांक वाले ठोस या तरल पदार्थ हैं।
• जबकि अकार्बनिक यौगिक उच्च गलनांक व क्वथनांक वाले ठोस पदार्थ होते हैं।
• कार्बनिक यौगिक, कार्बनिक विलायक जैसे – बेंजीन, एल्कोहल एवं क्लोरोफार्म में घुलनशील है, जबकि जल में अघुलनशील हैं।
• जबकि अकार्बनिक यौगिक जल में घुलनशील एवं कार्बनिक विलायक में अघुलनशील होते हैं।
• कार्बनिक यौगिकों की तुलना में अकार्बनिक पदार्थ आमतौर पर गर्मी और बिजली के कंडक्टर हैं।
• कार्बनिक यौगिकों की तुलना में अकार्बनिक पदार्थों की प्रतिक्रिया दर अधिक है।
• सभी कार्बनिक यौगिकों में कार्बन परमाणु होते हैं, जबकि अकार्बनिक पदार्थों में धातु एवं अन्य पदार्थ होते हैं।
कार्बन के ऑक्साइड –
मुख्यत: कार्बन के दो ऑक्साइड पाए जाते हैं –
(i) कार्बन मोनो ऑक्साइड (CO)
(ii) कार्बन डाई ऑक्साइड (CO2)
1. कार्बन मोनो ऑक्साइड (CO) –
• जब कार्बन या हाइड्रोकार्बन को ऑक्सीजन की सीमित आपूर्ति मे जलाते हैं तो कार्बन मोनोक्साइड प्राप्त होती है –
2C + O2 ® 2CO
• यह मोटर वाहनों के धुएँ के रूप मे उत्पन्न होती है। इस कारण इसे शहरों का मुख्य प्रदूषक कहा जाता हैं।
• कार्बन मोनोक्साइड का गलनांक –199°C एवं क्वथनांक –192°C है।
• यह एक रंगहीन और गंधहीन गैस है।
• यह एक प्रमुख वायु प्रदूषक है ओर बड़ी मात्रा में ऑटोमोबाइल इंजन से निकलती है।
• इसके कम विषाक्तता स्तर के कारण सिरदर्द एवं अनिद्रा जैसी समस्याएँ उत्पन्न होती हैं। इसकी अधिक मात्रा मृत्यु का कारण बन जाती है।
• कार्बन मोनोक्साइड विषैली होती है क्योंकि यह रक्त के हीमोग्लोबिन के साथ आबंधन करके रक्त की ऑक्सीजन प्रसारण क्षमता को कम कर देती है।
• यह वाटर गैस (CO+H2) तथा प्रोड्युसर गैस (CO+N2) में भी पाई जाती है।
• यह नीली लौ के साथ जलती है।
• सूर्य के प्रकाश की उपस्थिति में क्लोरीन गैस से अभिक्रिया करके विषैली गैस फॉस्जीन बनाती है।
❍ उपयोग
• यह धातु कर्म प्रक्रिया में धातु ऑक्साइड का अपचयन करने के लिए अपचायक का कार्य करता है। जैसे–धमन भट्टी में लोहे के ऑक्साइड का अपचयन लोहे में करने के लिए –
Fe2O3+3CO ® 2Fe + 3CO2
• कार्बन मोनोक्साइड को ईंधन के रूप में प्रयोग किया जाता है।
• इसे कार्बनिक यौगिकों के संश्लेषण में प्रयोग किया जाता हैं।
• कार्बन मोनोक्साइड कार्बोनिल यौगिक बनाता है। निकेल कार्बोनिल (Ni (CO)4) निकेल के शोधन में उपयोग होता है।
• यह उत्प्रेरक की उपस्थिति में हाइड्रोजन के साथ संगठन करके मेथेनॉल (CH3OH) बनाता है।
2. कार्बन डाईऑक्साइड –
• कार्बन युक्त पदार्थों को ऑक्सीजन की अधिकता में जलाने पर कार्बन डाईऑक्साइड प्राप्त होती है।
C + O2 ®CO2
CH4 + O2 ® CO2 + 2H2O
• कार्बोनेट को गर्म करने पर भी कार्बन डाई ऑक्साइड प्राप्त होती है – CaCO3 ® CaO +CO2
• कार्बन डाईऑक्साइड चीनी के किण्वन द्वारा एल्कोहल (इथेनॉल) उत्पादन के समय उपजात के रूप में भी प्राप्त होती है।
C6H12O6 ® 2C2H5OH +2CO2
ग्लूकोज इथेनोल
• कार्बन डाईऑक्साइड का जलीय विलयन कार्बोनिक अम्ल (H2CO3) कहलाता हैं।
• यह रंगहीन एवं गधंहीन गैस है।
• वातावरण में यह केवल 0.03% मात्रा में ही मौजूद है।
• ग्रीन हाउस प्रभाव में इसका प्रमुख योगदान है।
❍ कार्बन डाईऑक्साइड के उपयोग
• ठोस CO2 जिसे सूखी बर्फ कहा जाता हैं को प्रशीतक के रूप में प्रयोग किया जाता है, क्योंकि जब इसे वायुमंडलीय दबाव पर ठंडा करते हैं तो यह द्रव में नहीं परंतु ठोस में संघनित होती है। इस ठोस का तापमान –78°C है।
• यह कार्बोनेटड पेय के उत्पादन में प्रयोग किया जाता है।
• इसे वॉशिंग सोडा (Na2CO3.11H2O) एवं पाक सोडा (NaHCO3) के उत्पादन में प्रयोग में लिया जाता है।
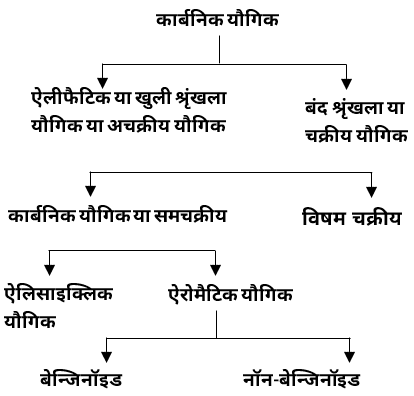
कार्बनिक यौगिकों का वर्गीकरण –
1. ऐलीफैटिक या खुली श्रृंखला वाले यौगिक –
• ऐलिफैटिक शब्द की उत्पत्ति ग्रीक भाषा के शब्द ऐलिफॉस से हुई है जिसका तात्पर्य ‘वसा’ से है –
• ऐसे कार्बनिक यौगिक जिनमें कार्बन के सभी परमाणु एक खुली श्रृंखला में जुड़े रहते हैं। ऐलीफैटिक यौगिक कहलाते हैं।
• इन यौगिकों को वसीय यौगिक भी कहा जाता हैं।
• इन यौगिकों मे कार्बन परमाणु सीधी या शाखित श्रृंखलाओं मे जुडे़ रहते हैं।
• मीथेन को सभी ऐलिफैटिक यौगिकों का जन्मदाता माना जाता हैं।
उदाहरण –
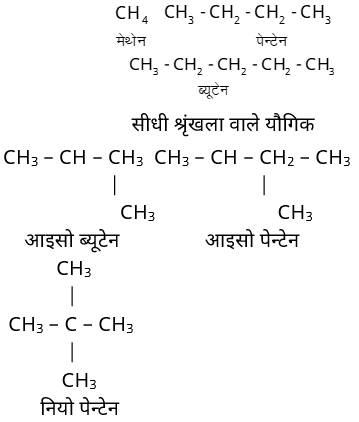
❍ शाखित श्रृंखला वाले यौगिक
• मेथेन सबसे सरल ऐलिफैटिक यौगिक है, जबकि बेन्जीन सबसे सरल ऐरोमैटिक यौगिक है।
2. चक्रीय या बंद श्रृंखला वाले यौगिक
• ऐसे यौगिक, जिनमें कार्बन परस्पर संयुक्त होकर एक बंद श्रृंखला बनाते हैं, बन्द श्रृंखला वाले या चक्रीय यौगिक कहलाते हैं।
❍ श्रृंखला के निर्माण के आधार पर चक्रीय यौगिकों को दो वर्गों में बाँटा गया है –
1. कार्बोचक्रीय या समचक्रीय यौगिक –ऐसे चक्रीय यौगिक जिनका निर्माण केवल कार्बन-परमाणुओं के संयोग से होता है। इन्हें पुन: दो वर्गों में बाँटा गया है –
i. ऐलिसाइक्लिक यौगिक –
• ऐसे यौगिक जिनमें कार्बन परमाणु परस्पर जुड़कर एक समचक्रीय वलय बनाते हैं।
• इस वलय में कभी-कभी कार्बन के अतिरिक्त अन्य परमाणु होते हैं। (विषम चक्रीय)
• ये यौगिक ऐरेामैटिक यौगिकों की तुलना में ऐलिफैटिक यौगिक से ज्यादा मिलते-जुलते हैं।
उदाहरण –
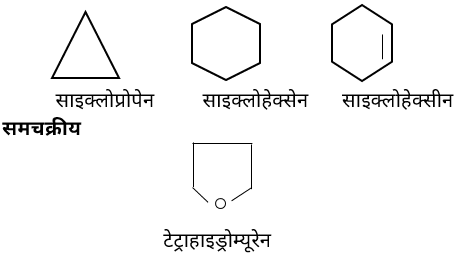
विषम चक्रीय
ii. ऐरोमैटिक यौगिक
• ऐरोमैटिक शब्द ग्रीक भाषा के शब्द ‘ऐरोमा’ से लिया गया है, जिसका तात्पर्य ‘सुगंध’ से है।
• इन यौगिकों की बंद श्रृंखला कार्बन के छ: परमाणुओं से निर्मित होती है।
• बेंजीन को ऐरोमैटिक यौगिकों का जन्मदाता माना जाता है।
• इनमें भी ऐलिसाइक्लिक यौगिकों की भाँति वलय में विषम परमाणु हो सकता है (विषम चक्रीय ऐरोमैटिक यौगिक)
2. विषम चक्रीय यौगिक –
• ऐसे चक्रीय यौगिक जिनकी बन्द श्रृंखला कार्बन के अतिरिक्त दूसरे तत्वों के परमाणुओं से मिलकर बनी होती है, विषम चक्रीय यौगिक कहलाते हैं।
उदाहरण – फ्यूरेन, थायोफिन, पिरीडीन, में सभी विषम चक्रीय यौगिक है जिनमे क्रमश: ऑक्सीजन गंधक, नाइट्रोजन तथा नाइट्रोजन विषम परमाणु है।
❍ क्रियात्मक समूह (Functional Group) –
कार्बनिक यौगिक में विशेष प्रकार से जुड़ा परमाणु या उनका समूह जो कार्बनिक यौगिकों में विशिष्ट रासायनिक गुणों के लिए उत्तरदायी होता हैं।
| यौगिक का वर्ग | क्रियात्मक समूह | समूह पूर्वलग्न | अनुलग्न | उदाहरण |
| फिनाइल | –C6H5 | फिनाइल | – | 1 – फिनाइल एथेन C6H5CH2CH3 |
| आइसोसायनाइड | –NC | – | आइसोनाइट्राइल | मेथिल आइसोनाइट्राइल CH3NC |
| ऐनहाइड्राइड | –COOCOR | – | ऐनहाइड्राइड | (ऐसीटिक ऐनहाइड्राइड) (CH3CO)2O |
| सल्फोनिक अम्ल | –SO3H | सल्फो | सल्फोनिक अम्ल | मेथिल सल्फोनिक अम्ल CH3SO3H |
| नाइट्रो | –NO2 | नाइट्रो | – | 1-नाइट्रोप्रोपेन CH3CH2CH2NO2 |
| एमाइड | –CONH2, –CONHR, –CONR2 | कार्बामायल | ऐमाइड | एथेनामाइड, CH3CONH2 |
| ऐमीन | –NH2, >NH, = N– | ऐमीनो | एमाइन | एथेनामीन, CH3CH2NH2 |
| एसिल हैलाइड | –COX (X =F, Cl, Br, I) | हैलोकार्बोनिल | ऑयल हैलाइड | एथेनॉयल क्लोराइड CH3 COCl |
| एस्टर | –COOR | ऐल्कॉक्सी कार्बोनिल | ओएट | CH3COOCH3 |
| कार्बोक्सिलेट आयन | –COO | – | ओएट | सोडियम मेथेनोएट HCOONa |
| कार्बोक्सिलिक अम्ल | –COOH | कार्बोक्सी | ओइल अम्ल | मेथेनॉइक मेथेन, HCOOH |
| ईथर | R–O–R | ऐल्कॉक्सी | – | मेथॉक्सी मेथेन, CH3OCH3 |
| नाइट्राइल | – C ≡ N | सायनो | नाइट्राइल | पेन्टेन नाइट्राइल CH3CH2CH2CN |
| कीटोन | >C=O | ऑक्सो | ओन | प्रोपेनोन, CH3COCH3 |
| एल्डिहाइड | –CHO | फॉर्मिल या ऑक्सो | एल | प्रोपेनल, CH3CH2CHO |
| एल्कोहॉल | –OH | हाइड्रॉक्सी | ऑल | प्रोपेन-2-ऑल OH l CH3–CH–CH3 |
| हैलाइड | –X(X = F, Cl, Br, l) | हैलो | – | 1-ब्रोमो ब्यूटेन CH3CH2CH2CH2Br |
| ऐरीन | – | – | – | |
| एल्काइन | –C≡C– | एल्काइनाइल | आइन | एसीटिलीन, HC≡CH |
| ऐल्कीन | >C=C< | एल्किनाइल | ईन | एथिलीन, H2C=CH2 |
| ऐल्केन | – | एल्किन(R) | ऐन | ब्यूटेन, CH3CH2CH2CH3 |
कार्बनिक रसायन की कुछ प्रमुख क्रियाएँ –
(1) सजातीय श्रेणी (Homologous Series) –
• कार्बनिक यौगिकों की ऐसी श्रेणी जिनके सभी सदस्यों में एक ही क्रियाशील मूलक उपस्थित हो।
• श्रेणी सदस्यों के रासायनिक गुणों एवं संरचना में परस्पर समानता पाई जाती है।
• इस श्रेणी के किन्हीं भी क्रमागत सदस्यों के मध्य हमेशा – CH2 – अंतर पाया जाता है, सजातीय श्रेणी कहलाता हैं।
• ऐसी श्रेणी के सदस्यों को सजात कहते हैं।
उदाहरण – मिथेन (CH4), एथेन (C2H6), प्रोपेन (C3H8), ब्यूटेन (C4H11) आदि सीधे श्रृंखला ऐल्केन हैं।
• एल्कोहॉल भी एक सजातीय श्रेणी का निर्माण करते हैं –
• मेथिल एल्कोहॉल (CH3OH), एथिल एल्कोहॉल (C2H5OH), – प्रोपिल एल्कोहॉल (C3H7OH), ब्यूटिल एल्कोहॉल (C4H9OH) तथा एमिल एल्कोहॉल (C5H11OH) आदि यह घटना समजातीयता (Homology) कहलाती हैं।
❍ सजातीय श्रेणी की विशिष्टता
• सजातीय श्रेणी के सदस्यों को एक ही सामान्य सूत्र द्वारा निरूपित किया जाता हैं।
उदाहरण – ऐल्केन श्रेणी का सामान्य सूत्र CnH2n+2, ऐल्कीन का CnH2n तथा एल्कोहॉल का CnH2n+1.OH
• सजातीय श्रेणी के सभी सदस्य अपने क्रमागत सदस्यों के अणुसूत्रों के मध्य –CH–2 इकाई का अंतर प्रदर्शित करते हैं।
• किसी सजातीय श्रेणी के सभी सदस्यों को कुछ सामान्य प्रतिक्रियाओं द्वारा बनाया जा सकता हैं।
• अणुभार में वृद्धि के साथ-साथ सजातीय श्रेणी के सदस्यों के भौतिक गुणों जैसे – क्वथनांक, गलनांक, घनत्व आदि में भी क्रमिक परिवर्तन होता है।
❍ समावयवता (Isomerism) –
• ऐसे यौगिक जिनके आण्विक सूत्र समान किन्तु इनके परमाणुओं की व्यवस्था भिन्न-भिन्न हो समावयवी (Isomers) कहलाते हैं तथा यह घटना समावयवता कहलाती है।
उदाहरण –
ब्यूटेन तथा आइसो ब्यूटेन का आण्विक सूत्र तो C4H11 के समान ही होता है, लेकिन संरचना सूत्र में असमानता के कारण इनके गुणों में अंतर पाया जाता हैं। अत: ये दोनों ब्यूटेन के समावयवी हैं।
❍ समावयवता को दो वर्गों में बाँटा जा सकता है –
(i) संरचनात्मक समावयवता
(ii) त्रिविम समावयवता
1. संरचनात्मक समावयवता –
• ऐसे कार्बनिक यौगिक जिनके अणुसूत्र समान हो, किन्तु संरचना अलग-अलग हो, यह घटना संरचनात्मक समावयवता कहलाती हैं।
अर्थात ऐसे यौगिक जिनके अणु में स्थित प्रत्येक तत्व के परमाणुओं की संख्या समान हो, लेकिन उनके मध्य अलग रासायनिक आबंध हो।
उदाहरण –
आण्विक सूत्र C5H12 के तीन श्रृंखलाएँ समावयवी निम्न प्रकार है –
• संरचनात्मक समावयवता को चार प्रकार से वर्गीकृत किया जा सकता है।
(i) श्रृंखला समावयता
(ii) स्थिति समावयवता
(iii) क्रियात्मक समूह समावयवता
(iv) मध्यावयवता
2. त्रिविम समावयता –
• ऐसे कार्बनिक यौगिक जिनमें अणुसूत्र तथा बंधित परमाणुओं का अनुक्रम समान होता हैं लेकिन अंतरिक्ष में उनके परमाणुओं के अभिविन्यास भिन्न-भिन्न होते हैं। यह घटना त्रिविम समावयवता कहलाती हैं।
• यह समावयवता दो प्रकार की होती है –
(i) ज्यामितीय समावयता (geometrical isomerism)
(ii) प्रकाशीय समावयता (Optical isomerism)
3. भंजन (Cracking) –
• ताप की उपस्थिति मे हाइड्रोकार्बन के उच्च अणुभार वाले अणुओं को निम्न अणुभार वाले अणुओं में तोड़नें की प्रक्रिया ‘भंजन’ कहलाती हैं।
उदाहरण –
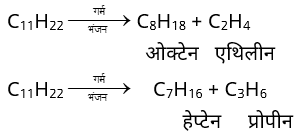
• पेट्रोलियम की बढ़ती आवश्यकता की पूर्ति के लिए इस तकनीक का उपयोग किया जाता है। भंजन द्वारा उच्च क्वथनांक वाले हाइड्रोकार्बनों को पेट्रोल में परिवर्तित किया जाता हैं।
हाइड्रोकार्बन
जैसा की नाम से स्पष्ट है हाइड्रोकार्बन केवल कार्बन एवं हाइड्रोजन से बने यौगिक हैं।
• पेट्रोलियम हाइड्रोकार्बन के प्रमुख स्रोत हैं।
❍ हाइड्रोकार्बन का वर्गीकरण –
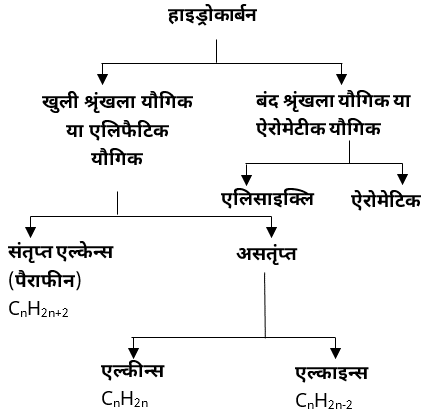
1. ऐलिफैटिक हाइड्रोकार्बन –
• ऐलिफैटिक शब्द, ग्रीक भाषा के शब्द ‘ऐलीफर’ से बना है जिसका अर्थ ‘वसा’ से है।
• इनको वसा एवं तेलों से प्राप्त करने के कारण हाइड्रोकार्बन नाम दिया गया।
• हाइड्रोकार्बन यौगिक चक्रीय एवं अचक्रीय हो सकते हैं जो क्रमश: कार्बन परमाणुओं की बंद श्रृंखला एवं सीधी श्रृंखला यौगिक हैं।
2. ऐरोमेटिक हाइड्रोकार्बन –
• ऐरोमेटिक शब्द ‘एरोमा’ से लिया गया है, जिसका तात्पर्य सुंगध से है।
• ऐरोमेटिक यौगिकों मे एक विशेष गंध होती है।
• ऐलिफैटिक हाइड्रोकार्बन को दो श्रेणियों में विभाजित किया जा सकता है –
1. संतृप्त हाइड्रोकार्बन (ऐल्केंस)
• संतृप्त हाइड्रोकार्बन में कार्बन के परमाणु परस्पर एकल आबंध से जुडे रहते हैं।
• इन्हें ऐल्केंस या पेराफिन भी कहा जाता हैं। पेराफिन से तात्पर्य ‘अल्प क्रियाशील’ से है। अत: संतृप्त हाइड्रोकार्बन की क्रियाशीलता बहुत कम होने के कारण इन्हें ‘पेराफिन’ कहा जाता है।
• ऐल्केन का सामान्य सूत्र CnH2n+2
जहाँ n एल्केन अणु में कार्बन के परमाणुओं की संख्या है।
• प्रथम दस एल्केन जिनमें n=1 से n=10 तक है।
• एल्केन्स रंगहीन एवं गंधहीन यौगिक हैं।
• एल्केन्स की क्रियाशीलता कम होती हैं।
• इनके अनेक यौगिक गैस या तरल रूप में पाए जाते हैं।
कुछ प्रमुख एल्केन और उनके भौतिक गुण –
| क्र.सं. | नाम | आण्विक सूत्र | आण्विक भार(g) | गलनांक (°C) | क्वथनांक (°C) | संरचनात्मक समावयतों की संख्या |
| 1 | मीथेन | CH4 | 16 | -183 | -162 | 1 |
| 2 | इथेन | C2H6 | 30 | – 172 | -89 | 1 |
| 3 | प्रोपेन | C3H8 | 44 | – 187 | -42 | 1 |
| 4 | ब्यूटेन | C4H10 | 58 | -138 | 0 | 2 |
| 5 | पेंटेन | C5H12 | 72 | -130 | 36 | 3 |
| 6 | हैक्सेन | C6H14 | 86 | -95 | 68 | 5 |
| 7 | हैप्टेन | C7H16 | 111 | -91 | 98 | 9 |
| 8 | ऑक्टेन | C8H18 | 114 | -57 | 126 | 18 |
| 9 | नोनेन | C9H20 | 128 | -54 | 151 | 35 |
| 10 | डेकेन | C10H22 | 142 | -30 | -174 | 75 |
2. असंतृप्त हाइड्रोजन
• असंतृप्त हाइड्रोकार्बन मे कार्बन परमाणुओं के मध्य परस्पर द्वि या त्रिक आबंध होते हैं।
• ऐसे असंतृप्त हाइड्रोकार्बन जिनमें कार्बन – कार्बन के मध्य (C=C) द्वि आबंध होता है, एल्कींस कहलाते हैं।
• जिन असंतृप्त हाइड्रोकार्बन के कार्बन-कार्बन के मध्य त्रि आबंध (C≡C) होता है एल्काइन्स कहलाते हैं।
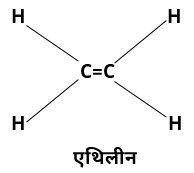
i. एल्कींस या ओलिफिन –
ऐसे असंतृप्त ऐलिफैटिक हाइड्रोकार्बन जिनके दो कार्बन परमाणुओं के मध्य द्विबंधन होता है।
• इनका प्रथम सदस्य एथिलीन अथवा एथीन C2H4 है।
• एल्कींस भी एल्केंस की तरह यौगिकों की सजातीय श्रेणी बनाते हैं जिसमें प्रत्येक सदस्य एक CH2 इकाई द्वारा अगली श्रेणी से अलग रहता है।
• एल्कीस की सजातीय श्रेणी को सामान्य सूत्र CnH2n द्वारा प्रदर्शित किया जाता है।
जहाँ n एल्कीन अणु में कार्बन के परमाणुओ की संख्या को प्रदर्शित करता है।
उदाहरण – एथिलीन (C2H4)
ii. एल्काइन्स –
• ऐेसे असंतृप्त हाइड्रोकार्बन जिनमें दो कार्बन परमाणुओं के मध्य त्रि-बंधन होता हैं ऐसीटिलिन श्रेणी के हाइड्रोकार्बन या एल्काइन्स कहलाते हैं।
• इनका सामान्य सूत्र CnH2n-2 होता है।
• इसका प्रथम सदस्य ऐसीटिलिन या इथाइन C2H2 है।
• सबसे सरल एल्काइन इथाइन है। इसका आण्विक सूत्र C2H2 है।
• इसे ऐसेटिलीन भी कहा जाता हैं। यह कैले व आम जैसे फलों को पकानें में काम में लिया जाता है।
• इसे ऑक्सीजन के साथ आक्सी-ऐसेटिलीन मशाल में वेल्डिंग में भी प्रयोग किया जाता है।
H – C ≡ C – H (C2H2)
3. ऐरोमैटिक हाइड्रोकार्बन –
• कार्बन एवं हाइड्रोजन से मिलकर बने ऐसे हाइड्रोकार्बन यौगिक जिनमें बेंजीन के समान श्रृंखला पाई जाती है। ऐरोमैटिक हाइड्रोकार्बन कहलाते हैं।
• इनका सामान्य सूत्र CnH2n-6
• ऐरोमैटिक हाइड्रोकार्बन में बेंजीन के समान वलय संरचना एवं विशेष प्रकार की गंध पाई जाती है।
• इनकी विशेष गंध के कारण इन्हें ‘एरीन’ भी कहा जाता हैं।
• बैंजीन सरलतम हाइड्रोकार्बन है। इसके अतिरिक्त टॉलुईन, नेफ्थैलिन, ऐन्थ्रासीन तथा बाइफेंनिल आदि ऐरोमैटिक हाइड्रोकार्बन है।
कुछ महत्वपूर्ण कार्बनिक यौगिकों के सामान्य सूत्र
| क्र.सं. | कार्बनिक यौगिक | सामान्य सूत्र |
| 1 | एल्केन | CnH2n+2 |
| 2 | एल्कीन | CnH2n |
| 3 | एल्काइन्स | CnH2n-2 |
| 4 | एल्काइल हैलाइड | CnH2n+1x |
| 5 | एल्कोहॉल | CnH2n+2O |
| 6 | ईथर | CnH2+2O |
| 7 | एल्डिहाइड एवं कीटोन | CnH2nO |
| 8 | कार्बोक्सिलिक अम्ल | CnH2nO2 |
| 9 | प्राथमिक ऐलीफेटीक एमीन | CnH2n+1 NH2 |
| 10 | कार्बोहाइड्रेट | Cx(H2O)y |
महत्वपूर्ण कार्बनिक यौगिक एवं उनके अनुप्रयोग –
1. ग्लूकोज –
• रासायनिक सूत्र – C6H12O6
• ग्लूकोज कार्बोहाइड्रेट का एक प्रकार हैं जिसे साधारण शर्करा एवं डेक्सट्रोज भी कहा जाता है।
उपयोग-
• अनेक तरह की शराब बनाने में, कैल्शियम ग्लूकोनेट नामक औषधि के रूप में।
• ग्लूकोस के रूप में, मिठाईयाँ, मुरब्बा तथा फलों को सुरक्षित रखने में।
2. यूरिया – रासायनिक सूत्र – CH4N2O
• यूरिया को कार्बामाइड भी कहा जाता है।
• यूरिया प्रथम कार्बनिक पदार्थ हैं जिसे कृत्रिम रूप से प्रयोगशाला में संश्लेषित किया गया है।
• वोहलर द्वारा 1828 में इसे अमोनियम सायनेट से प्रयोगशाला में संश्लेषित किया गया है।
उपयोग –
• प्राणियों में नाइट्रोजन युक्त यौगिकों के उपापचय (metabolism) में यूरिया का मुख्य योगदान रहता हैं।
• नाइट्रोजनी उर्वरक के रूप में, त्वचा एवं बालों के सौंदर्य प्रसाधनों के निर्माण में।
• यूरिया नाइट्रेट नामक विस्फोटक के निर्माण में।
• फॉर्मल्डिहाइड तथा यूरिया प्लास्टिक बनाने में तथा अनेक दवाओं के उत्पादन में।
3. ऑक्सेलिक अम्ल – रासायनिक सूत्र – C2H2O4
• आक्सेलिक अम्ल द्वि – कार्बोक्सिलिक अम्ल हैं।
• यह एक अपचायक अभिकर्ता (Reducing Agent) है।
उपयोग –
• इसे पोटैशियम लवण के रूप में अनेक वनस्पतियों से प्राप्त किया जाता है।
• फेरस ऑक्जलेट के रूप में इसका उपयोग फोटोग्राफी में भी किया जाता है।
• जंग हटाने में, खनिजों के सफाई में, फार्मिक अम्ल, पॉलिश आदि के निर्माण में।
• चमड़े के विरंजन में, कपड़ों की छपाई तथा रंगाई में।
• 10% विलियन से रोशनाई के निशान साफ करने में तथा रोशनाई एवं कोलतार के रंग बनाने में।
4. बेंजीन – रासायनिक सूत्र – C6H6
• बेंजीन को फैराडे द्वारा खोजा गया।
• बेंजीन को सभी ऐरोमैटिक यौगिकों का जन्मदाता कहा जाता है।
उपयोग –
• एरोमैटिक यौगिकों के निर्माण में, विस्फोटकों के निर्माण में।
• विलायक के रूप में, शुष्क धुलाई में, पेट्रोल के साथ मिश्रण कर इंजनों के ईंधन के रूप में।
5. टॉलूईन –रासायनिक सूत्र – C7H8
• टॉलूईन को सर्वप्रथम ‘टॉलू बाल्सम’ नामक रेजिन के शुष्क स्राव द्वारा प्राप्त किया गया।
• इसका व्यापारिक नाम टॉलूऑल (Toluol) है।
उपयोग –
• सैकरीन एवं क्लोरामिन-टी नामक औषधि के निर्माण में, विलायक के रूप में।
• टी.एन.टी. विस्फोटक के निर्माण में, पेट्रोल एवं बेंजीन के साथ हिमरोधी के रूप में।
• दवा उद्योग में, रंग उद्योग में, शुष्क धुलाई में तथा विस्फोटक बनाने में।
6. क्लोरोबेंजिन – रासायनिक सूत्र – C6H5Cl
• यह एरोमैटिक कार्बनिक यौगिक है।
• क्लोरोबेंजिन रंगहीन एवं ज्वलनशील होता हैं।
उपयोग –
• कार्बनिक यौगिकों जैसे – फीनॉल, ऐनिलीन, क्लोरोनाइट्रो बेंजीन के निर्माण में।
• डी.डी.टी नामक कीटनाशक के रूप में।
7. नाइट्रोबेंजीन – रासायनिक सूत्र – C6H5NO2
• नाइट्रोबेंजीन हल्के पीले रंग का बादाम जैसी गंध वाल तेल है जिसे मिरबेन का तेल भी कहा जाता हैं।
• इसे बेंजीन से एनिलिन के निर्माण की प्रक्रिया में बनाया जाता है।
• यह एरोमैटिक नाइट्रो यौगिक श्रेणी का प्रथम सदस्य है।
• नाइट्रो बेंजीन को सर्वप्रथम मिश्चरलिच द्वारा 1834 में प्राप्त किया गया।
उपयोग –
• टी.एन.बी (ट्राइनाइट्रोबेंजीन) विस्फोटक के निर्माण में।
• एनिलिन एवं अनेक कार्बनिक यौगिकों के निर्माण में इसका उपयोग किया जाता है।
• साबुन, पोलिश तथा मिरबेन के तेल में सस्ती सुंगध के रूप में।
8. ऐनिलीन – रासायनिक सूत्र – C6H5NH2
• ऐनिलीन शब्द की उत्पत्ति, पुर्तगाली शब्द ‘ऐनिल’ से हुई जिसका तात्पर्य ‘नील’ से है।
• ऐनिलीन बेंजीन का एमिनों व्युत्पन्न हैं।
उपयोग –
• औषधियों के निर्माण एवं रंजकों के उत्पादन में।
• रबड़ उद्योग में भी इसका उपयोग किया जाता है।
9. फिनॉल –रासायनिक सूत्र – C6H6O
• इसे कार्बोलिक अम्ल भी कहा जाता हैं।
• फिनॉल बेंजीन का मोनोहाइड्रोक्सी व्युत्पन्न हैं।
उपयोग –
• फिनॉल्फथैलीन, सैलिसिलिक अम्ल के निर्माण में।
• जीवाणुनाशक के रूप में, बेकेलाइट के निर्माण में।
• कार्बोलिक साबुन बनाने में, एस्पीरिन तथा सेलोल बनाने में।
10. क्लैथरेट –
• क्लैथरेट समुद्री तलहटी में जमा ईंधन है।
• यह मुख्य रूप से जल के अणुओं के मध्य फँसी मिथेन गैस (CH4) है।
उपयोग –
• इलेक्ट्रॉनिक उद्योग में।
• ऑप्टिकल तथा फार्मेसी उद्योग में।
• रेफ्रिजरेटर में प्रशीतक के रूप में, वातानुकुलित इलेक्ट्रॉनिक उपकरणों में।
11. बेंजाल्डिहाइड – रासायनिक सूत्र – C7H6O
• बेंजाल्डिहाइड रंगहीन बादाम की गंध वाला कार्बनिक यौगिक है।
उपयोग –
• मुख्य रूप से सुगंधित पदार्थों के निर्माण में तथा रंग उद्योग में।
• रासायनिक क्रियाओं में।
12. इथाइल एसीटेट –रासायनिक सूत्र – C4H8O2
• इसका उपयोग मुख्य रूप से दवाओं में तथा कृत्रिम सुंगध उत्पन्न करने में किया जाता हैं।
13. एसीटामाइड –रासायनिक सूत्र – C2H5NO
• कपड़े तथा चमड़े को मुलायम करने में इसका उपयोग किया जाता है।
14. इथाइल एल्कोहॉल –रासायनिक सूत्र – C2H5OH
• इथाइल एल्कोहॉल रंगहीन द्रव है।
• इसे पेय पदार्थ के रूप में सेवन करने पर मानव शरीर में उत्तेजना उत्पन्न होती है।
• औद्योगिक दृष्टी से इसका उत्पादन किण्वन विधि से किया जाता है।
उपयोग –
• शराब तथा अन्य एल्कोहलीय पेय पदार्थ बनाने में, टिंचर बनाने में।
• कीटाणुनाशक के रूप में, घाव को साफ करने में, मोटर कार इंजनों में ईंधन के रूप में।
• स्प्रिट लैम्प और स्टोवों में, पारदर्शक साबुन बनाने में, वार्निश तथा पॉलिश बनाने में।
• विलायक के रूप में, रंग उद्योग में।
15. ग्लिसरॉल – रासायनिक सूत्र – C3H8O3
• ग्लिसरॉल प्रोपेन का ट्राइहाइड्रॉक्सी व्युत्पन्न है।
• इसका व्यापारिक नाम ग्लिसरीन है।
• ग्लिसरॉल स्वतंत्र अवस्था में शक्कर के किण्वित घोल एवं रक्त में अत्यंत कम मात्रा में पाया जाता हैं, जबकि संयुक्त अवस्था में वसा तथा वनस्पति तेलों में उच्च कार्बनिक अम्लों के ग्लिसराइड के रूप में पाया जाता हैं।
• ग्लिसरॉल सांद्र सल्फ्यूरिक अम्ल की उपस्थित में सांद्र नाइट्रिक अम्ल से क्रिया कर ग्लिसरिल ट्राइनाइट्रेट (ट्राइनाइट्रों ग्लिसरीन या टी.एन.जी) बनाता है।
• टी.एन.जी एक विस्फोटक पदार्थ हैं जिसका उपयोग डायनामाइट बनाने में किया जाता है।
उपयोग –
• शक्तिवर्द्धक औषधि बनाने में, परिरक्षक के रूप में।
• घड़ियों के कलपुर्जों को चिकना रखने में, मोहरों की स्याही, जूते की पॉलिश तथा श्रृंगार सामग्री बनाने में।
• पारदर्शक साबुन बनाने में, सूजन वाले स्थान को ठंडक पहुँचाने में।
• मिठाई, शराब एवं फलों के संरक्षण में।
16. फार्मल्डिहाइड – रासायनिक सूत्र – CH2O
उपयोग –
• जीवाणुनाशक के रूप में।
• फोटोग्राफी प्लेटों पर जिलेटिन फिल्म को स्थिर रखने में।
• अंडें की सफेदी से वाटरप्रूफ कपड़ा बनाने में।
17. एसीटेल्डिहाइड – रासायनिक सूत्र – C2H4O
उपयोग –
• प्लास्टिक बनाने में, रंग तथा दवा बनाने में।
• मेटा ऐसेटल्डिहाइड नामक नींद की दवा बनाने में।
18. ऐसीटोन – रासायनिक सूत्र – C3H6O
• कृत्रिम रेशम तथा संश्लेषित रबर बनाने में।
• सल्फोनल, क्लोरेटोन, क्लोरोफॉर्म, आयडोफॉर्म दवाओं के निर्माण में।
• वार्निश तथा क्लोडियन सेल्युलोस बनाने में।
19. फॉर्मिक अम्ल – रासायनिक सूत्र – CH2O2
• इसे मेथेनोइक अम्ल भी कहा जाता हैं।
• यह लाल चींटियों द्वारा भी उत्सर्जित किया जाता है।
• यह एक प्रकार का मोनो-कार्बोक्सिलिक अम्ल है।
उपयोग –
• चमड़े के शोधन एवं रंगाई में, सूती एवं ऊनी वस्त्रों की रंगाई में।
• रोगाणुनाशी के रूप में, गठिया रोग की दवा बनाने में।
• रबर के स्कंदन (Coagulation) में एवं जैविक लैटेक्स के निर्माण में।
• कृत्रिम सुगंध एवं इत्र निर्माण में।
20. एसीटिक अम्ल – रासायनिक सूत्र – CH3COOH
• इसे एथेनोइक अम्ल (CH3 COOH) भी कहा जाता हैं।
• यह सिरके में (4 – 6%) उपस्थित होता है।
• एसीटिक अम्ल को व्यापारिक स्तर पर पाइरोलिग्नियस अम्ल से प्राप्त किया जाता है।
उपयोग –
• रोगाणुरोधी के रूप में, फोटोग्राफी फिल्म के निर्माण में।
• पॉली विनाइल एसीटेट एवं सेल्युलोज एसीटेट जैसे कृत्रिम रेशों के निर्माण में।
• सिरके के रूप में, आचार, चटनी बनाने में।
• प्रयोगशाला में अभिकर्मक के रूप में, औषधि तथा रंग उद्योग में।
21. एसीटाइल क्लोराइड – रासायनिक सूत्र – CH3COCl
• इसका उपयोग एसीटामाइड तथा एसीटिक ऐन्हाइड्राइड बनाने में किया जाता है।
22. एसीटिक ऐन्हाइड्राइड – रासायनिक सूत्र – C4H6O3
• एस्पीरिन नामक दवा बनाने में।
• रंग उद्योग में तथा सेल्युलोस से नकली रेशम बनाने में।
23. मिथेन – रासायनिक सूत्र – CH4
• मिथेन एक कार्बनिक गैस हैं जिसे मार्श गैस भी कहा जाता हैं।
• मिथेन ऐल्केन श्रेणी का प्रथम सदस्य है।
• इसकी आकृति समचतुष्फलकीय होती है।
• मिथेन प्राकृतिक रूप से सब्जियों के विघटन से प्राप्त की जाती है।
उपयोग –
• हाइड्रोजन के औद्योगिक उत्पादन में, गैसीय ईधन के रूप में।
• कार्बनिक यौगिकों मेथिल एल्कोहॉल, फार्मेल्डीहाइड एवं क्लोरोफार्म के निर्माण में।
• काले रंग, यातायात टायर तथा छापाखानें की स्याही बनाने में।
• प्रकाश तथा ऊर्जा उत्पादन में।
24. ब्यूटेन –रासायनिक सूत्र – C4H8
• ब्यूटेन अत्यधिक ज्वलनशील, रंगहीन गैस है।
• इसका उपयोग मुख्य रूप से द्रव अवस्था में LPG के रूप में किया जाता है।
25. एसीटिलीन – रासायनिक सूत्र – C2H2
• एसीटिलीन को प्रयोगशाल में कैल्सियम कार्बाइड पर जल की प्रतिक्रिया द्वारा उत्पन्न किया जाता है।
• एसीटिलीन एल्काइन श्रेणी का प्रथम सदस्य है।
उपयोग –
• कपूर बनाने में, निश्चेतक के रूप में।
• धातुओं को जोड़ने एवं काटने में, बेंजीन के संश्लेषण में।
• निओप्रीन नामक कृत्रिम रबर बनाने में, कच्च फलों को कृत्रिम रूप से पकाने में।
• प्रकाश उत्पन्न करने में, ऑक्सी एसीटिलीन ज्वाला उत्पन्न करने में।
26. एथीलिन –रासायनिक सूत्र – C2H4
• एथीलिन ऐल्कीन श्रेणी का प्रथम सदस्य है।
उपयोग –
• पॉलीथीन प्लास्टिक बनाने में, निश्चेतक के रूप में।
• मस्टर्ड गैस बनाने में, कच्चे फलों को पकाने एवं उनके संरक्षण में।
• ऑक्सी एथीलीन ज्वाला उत्पन्न करने में किया जाता है।
27. पॉलीथिन – रासायनिक सूत्र – (C2H4)n
• पॉलीथीन, थर्मोप्लास्टिक है जिसे एथिलीन के बहुलीकरण से प्राप्त किया जाता हैं।
उपयोग –
• पैकिंग थैलियाँ बनाने में।
• विद्युत तारों के विद्युत रोधन में पाइप, बाल्टी, गिलास बनाने में।
• बोतलों की टोपियों के स्तर में, मजबूत बोतल बनाने में किया जाता हैं।
28. पॉलीस्टाइरीन – रासायनिक सूत्र – (C8H8)n
• इसका उपयोग संचायक सेलों के केस बनाने में, अम्ल की बोतलों की टोपियाँ बनाने में किया जाता हैं।
29. एथिल ब्रोमाइड – रासायनिक सूत्र – C2H5Br
• इसका उपयोग स्थानीय निश्चेतक के रूप में किया जाता है।
30. क्लोरोफॉर्म – रासायनिक सूत्र – CHCl3
• क्लोरोफार्म रंगहीन मधुर सुगंध वाला गाढ़ा द्रव हैं, जिसे ट्राइक्लोरोमीथेन भी कहा जाता हैं।
• क्लोरोफॉम को सर्वप्रथम लीबिग द्वारा 1831 में खोजा गया।
• सिम्पसन द्वारा बताया गया की यह निश्चेतक है।
• क्लोरोफोर्म प्रकाश की उपस्थिति में ‘फॉस्जीन’ (COCl2) नामक विषाक्त गैस का निर्माण करता हैं इस कारण इसे रंगीन बोतलों में भरकर रखा जाता है।
उपयोग –
• वसा, तेल, रबड़ एवं मोम आदि के विलायक के रूप में।
• शल्य क्रिया में निश्चेतक के रूप में, जीवाणुनाशक होने के कारण जन्तुओं एवं वनस्पतियों से प्राप्त पदार्थों के संरक्षण में।
31. मिथाइल एल्कोहॉल – रासायनिक सूत्र – CH3OH
उपयोग –
• कृत्रिम रंग बनाने में।
• वार्निश तथा पॉलिश बनाने में।
• पेट्रोल के साथ मिलाकर इंजनों में ईंधन के रूप में।
• मिथिलेटेड स्प्रीट बनाने में।
32. बेन्जोइक अम्ल – रासायनिक सूत्र – C7H6O2
• इसका उपयोग दवा बनाने में तथा फलों के रसों के संरक्षण में किया जाता है।
33. बेन्जीन सल्फोनिक अम्ल – रासायनिक सूत्र – C6H6O3S
उपयोग –
• सल्फा ड्रग्स बनाने में।
• सैकेरीन बनाने में तथा विलेय रंगों के निर्माण में।
34. ईथर – रासायनिक सूत्र – (C2H5)2O
उपयोग –
• मुख्य रूप से निश्चेतक के रूप में।
• विलायक के रूप में तथा एल्कोहॉल बनाने में।
35. कार्बन टेट्राक्लोराइड – रासासनिक सूत्र – CCl4
• अग्निशामक के रूप में ।
36. क्लोरोफ्लोरोकार्बन्स (CFCs) – रासासनिक सूत्र – CCl2 F2
• CFC क्लोरीन, फ्लोरीन एवं कार्बन की उपस्थिति वाले मानवनिर्मित कार्बनिक यौगिक है।
• CFC अविषाक्त एवं अज्वलनशील होते हैं, इन्हें फ्रेऑन्स भी कहा जाता हैं।
• CFC ओजोन परत का क्षरण करते हैं तथा हरित ग्रह प्रभाव को बढ़ाते है।
उपयोग –
• एसी एवं रेफ्रिजरेटर में प्रशीतक के रूप में।
• ऐरोसाल प्रणोदक के रूप में।
• ड्राइक्लीनिंग में विलायक के रूप में।
• चिकनाई कम करने वाले विलायक के रूप में।
37. डाइक्लोरोमेथेन – रासासनिक सूत्र – CH2 Cl2
• डाइक्लोरोमेथेन वाष्पशील, रंगहीन एवं मधुर गंध वाला द्रव है।
• यह अनेक कार्बनिक विलायकों में विलेय लेकिन जल में अविलेय।
उपयोग –
• विलायक के रूप में।
• चाय एवं कॉफी से कैफीन हटाने में।
• एरोसॉल प्रणोदक के रूप में तथा पेंट हटाने में।
38. मिथाइल आइसो सायनेट – रासासनिक सूत्र – CH3 NCO
• इसे मिक (MIC) गैस के नाम से भी जाना जाता है।
• भौपाल गैस त्रासदी (1984 ई.) इसी गैस के रिसाव के कारण हुई थी।
• मिक गैस का रिसाव यूनियम कार्बाइड संयंत्र से हुआ था।
• यह रंगहीन, विषाक्त एवं ज्वलनशील द्रव है।
उपयोग –
• कार्बोमेट कीटनाशकों के निर्माण में।
• रबड़ एवं गोंद निर्माण में।
39. अश्रु गैस (Tear gas) –
• अश्रु गैस को लैक्रीमेटर भी कहा जाता हैं।
यह मुख्यत: तीन प्रकार की होती है –
i. CS (2 – क्लोरोबेन्जाल मालोनाइट्राइल) – C10H5 ClN2
ii. CN (क्लोरोएसीटोफीनोन) – C8H7ClO
iii. OS (ओलियम केप्सिकम) – इसे मिर्च पाउडर से बनाया जाता है।
उपयोग –
• मुख्य रूप से पुलिस द्वारा अनियंत्रित भीड़ को हटाने में किया जाता है।
40. मस्टर्ड गैंस – रासानिक सूत्र – C4H8Cl2S
• इसे सल्फर मस्टर्ड के नाम से भी जाना जाता है।
• यह अत्यन्त विषैली गैस है जिसका उपयोग प्रथम विश्व युद्ध के समय रासायनिक हथियार के रूप में किया गया था।
• मस्टर्ड गैस को सल्फर डाइक्लोराइड (SCl2) तथा एथिलीन (C2H4) की अभिक्रिया से प्राप्त किया जाता है।
• इसमें सरसों जैसी गंध आती है।
• त्वचा के संपर्क में आने पर त्वचा पर फफोलें (Blisters) उत्पन्न करती है।
41. D.D.T(डाइक्लोरो डाइफिनाइल ट्राइक्लोरो एथेन)–
• इसके कीटनाशक गुण की खोज सर्वप्रथम 1939 में पॉल हरमैन मुलर द्वारा की गई।
• D.D.T रंगहीन, गंधहीन, स्वादहीन एवं रवेदार कार्बनिक पदार्थ है।
• अनेक प्रकार के कीटों के विरुद्ध संपर्क रसायन के रूप में D.D.T की क्षमता का पता लगाने के लिए 1948 में मुलर को नोबेल पुरस्कार से सम्मानित किया गया।
उपयोग –
• कीटनाशकों के रूप में, लेकिन पर्यावरणीय दुष्प्रभाव के कारण इसमें कमी की जा रही है।
• द्वितीय विश्व युद्ध के समय मलेरिया एवं टाइफस रोगों के खिलाफ इसका प्रयोग किया गया था।
42. एस्पिरिन – रासायनिक सूत्र – C9H8O4
• एस्पिरिन को प्राकृतिक रूप से विलो नामक पेड़ की छाल से प्राप्त किया जाता है।
• इसका रासायनिक नाम एसिटिल सैलिसिलिक एसिड (ASA) है।
उपयोग –
औषधि के रूप में, ज्वर, दर्द, जलन आदि के उपचार में।
43. यूरोट्रॉपिन – रासायनिक सूत्र – C6H12N4
• औद्योगिक स्तर पर इसका निर्माण फॉर्मेल्डिहाइड़ एवं अमोनिया की अभिक्रिया से संपन्न होता है।
• इसका रासायानिक नाम हेक्सामेथिलीन टेट्रामाइन अथवा मेथेन एमीन है।
उपयोग –
• मुख्य रूप से फीनॉलिक रॉल के निर्माण में।
• औषधियों के रूप में मूत्रमार्ग में संक्रमण से संबंधित रोगों के उपचार में।
44. नेफ्थेलीन – रासायनिक सूत्र – C10H8
• इसे मुख्यत: कोलतार से प्राप्त किया जाता है।
• यह सबसे सरल बहुचक्रीय ऐरोमैटिक हाइड्रोकार्बन है जो स्वत: रवेदार ठोस के रूप में पाया जाता है।
उपयोग –
• आतिशबाजी (Pyrotechnic) में विशेष प्रभाव उत्पन्न करने में।
• प्लास्टिक, रॉल एवं रंगो के निर्माण में।
• कपडों को कीड़ों से दूर रखने वाली गोलियों के निर्माण में।
• कीटाणुनाशी के रूप में।
45. रिसर्च डिपार्टमेंट एक्सप्लोसिव (RDX)– रासायनिक सूत्र – C3H6N6O6
• सर्वप्रथम जॉर्ज फ्रेडरिक हेनिंग द्वारा 1898 में इसका निर्माण किया गया।
• इसका रासयनिक नाम साइक्लोट्राई – मेथिलीनट्राई नाइट्राइमाइन अथवा साइक्लोनाइट है।
• यह अत्यधिक विनाशकारी विस्फोटक है।
उपयोग –
द्वितीय विश्व युद्ध के समय व्यापक स्तर पर इसका प्रयोग विस्फोटक के रूप में किया गया।
• वर्तमान में भी इसे विस्फोटक के रूप में ही काम में लिया जाता है।
46. ट्राइनाइट्रो टॉलूईन (TNT)–
• रासायनिक सूत्र – C7H5N3O6
• इसका निर्माण सर्वप्रथम 1863 में जूलियस विलब्राण्ड द्वारा किया गया।
• यह पीले रंग का ठोस रासायनिक पदार्थ है।
• यह भी विस्फोटक पदार्थ है। इसके इस गुण का पता कार्ल हॉसरमैन द्वारा 1863 में लगाया गया।
उपयोग –
• औद्योगिक क्षेत्र में, सैन्य उद्देश्यों में।
• खनन हेतु चट्टानों को तोड़ने के लिए विस्फोटक के रूप में।
47. लैक्टिक अम्ल – रासायनिक सूत्र – C3H6O3
• लैक्टिक अम्ल को प्राकृतिक एवं कृत्रिम दोनों प्रकार से प्राप्त किया जा सकता है।
• मनुष्य की माँसपेशियों में लैक्टिक अम्ल की मात्रा ज्यादा होने पर थकान का अनुभव होता है।
• यह मुख्यत: दूध एवं दूध से निर्मित खाद्य पदार्थों में पाया जाता है।
उपयोग –
• चमड़े की रंगाई में।
• औषधि निर्माण में।
• सौंदर्य प्रसाधन एवं दही, आचार आदि के निर्माण में।
48. एल.एस.डी. (लाईसर्जिक अम्ल डाइथाइलेमाइड) –
• यह भ्रम उत्पदन करने वाली दवा है।
49. क्लोरोटोन – रासानियक सूत्र – C4H7Cl3O
• KOH की उपस्थिति में ऐसीटोन क्लोरोफार्म के संघनित होकर इसका निर्माण करता है।
• इसका मुख्य रूप से उपयोग समुद्री एवं पहाड़ी यात्रा के दौरान चक्कर आने से रोकने की दवा के रूप में किया जाता है।
50. क्लोरल –
• क्लोरल पर ऐसीटल्डिहाइड की क्रिया से प्राप्त किया जाता है।
• इसका रासायनिक नाम ट्राइक्लोरोऐसीटल्डिहाइड है।
• यह तेलीय एवं रंगहीन द्रव है।
• इसका उपयोग मुख्य रूप से डी.डी.टी बनाने में किया जाता है।
अन्य अध्ययन सामग्री
महत्वपूर्ण प्रश्न
नमस्कार यहां पर आपको कार्बन तथा उसके यौगिक (Carbon & Their Compounds) से समबन्धित महत्वपूर्ण प्रश्न दिए जा रहे है। जिनके अध्ययन से आप अपनी परीक्षा की तैयारी को और अधिक अच्छा कर पाएँगे।